Диана Вальштад. Растения - очистители воды
1. Водные растения быстро поглощают тяжелые металлы.
2. Гуминовые вещества, образовывающиеся при разложении отмерших частей растений, связывают тяжелые металлы, что делает их нетоксичными.
3. Водные растения быстро поглощают аммоний и нитриты.
Тяжелые металлы
Все тяжелые металлы, вне зависимости от того, являются ли они питательными микроэлементами (цинк, медь, железо, марганец, никель) или загрязнителями окружающей среды (алюминий, свинец, ртуть, кадмий и т. д.), токсичны для живых организмов. В таблице приведены металлы, отсортированные в порядке убывания токсичности для разных организмов:
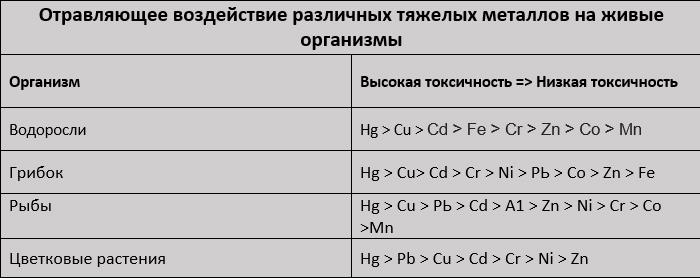
Как видно из таблицы - ртуть и медь наиболее токсичные металлы.
Металлы в водопроводной воде
Многие думают, что если водопроводная вода пригодна для питья, значит она пригодна и для рыб. Тут не все так просто, особенно касаемо цинка и меди. Во-первых, безопасные для рыб концентрации металлов намного меньше, чем для человека. Например, по меди они в 65 раз ниже, а по цинку в 50 раз. Во-вторых, медь и цинк вообще не считаются опасными для человека - предельно допустимые концентрации относятся только к вкусу, цвету и т. д. Поэтому вполне пригодная для питья водопроводная вода, может быть непригодной для рыб.
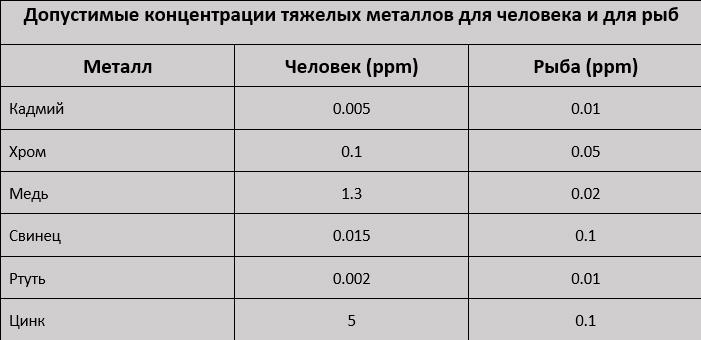
На муниципальных станциях водоподготовки, в результате процедур коагуляции/флокуляции и смягчения воды, цинк и медь могут быть удалены. Таким образом загрязнение водопроводной воды тяжелыми металлами кажется маловероятным. Однако были сообщения, что в некоторых районах обнаруживался высокий уровень меди. Также могут быть превышения нормы по концентрации цинка и меди в воде частных скважин и колодцев. Действительно, одно исследование [6] подземных вод США показывает огромный разброс как по меди Cu (0,01-2,8 ppm), так и по Zn (0,1-240 ppm). Дополнительное загрязнение питьевой водой тяжелыми металлами может происходить в результате выщелачивания металлических труб, нагревательных змеевиков и накопительных резервуаров.
В:
Меня заинтересовали ваши выводы относительно загрязнения аквариума тяжелыми металлами. Маловероятно, что в муниципальном водопроводе окажется вода, способная причинить вред водным обитателям; в данной ситуации единственным источником загрязнения могут быть водопроводные трубы. В самой же воде опасность представляет только хлор, от которого и надо избавляться.
О:
Не уверена в этом. И цинк, и медь могут присутствовать в питьевой воде в концентрациях, опасных для рыб. В воде из моего собственного колодца достаточно много цинка, чтобы создать проблемы аквариумной живности (по видимому из-за выщелачивания металла из самого колодца, либо из металлического накопительного резервуара). Еще было несколько сообщений от аквариумистов о проблемах, возникших из-за высокой концентрации меди в муниципальном водопроводе. Другие же могут вообще не догадываться о присутствии тяжелых металлов, списывая болезни рыб и растений на другие причины.
Отравления тяжелыми металлами редко обсуждаются в аквариумной литературе. Это интересная тема, затрагивающая питательные микроэлементы, физиологию рыб и процессы разложения. На мой взгляд она заслуживает некоторого внимания.
В:
Правда, что если вода пригодна для питья, то она безопасна для рыб?
О:
Люди не живут и не дышат в воде, поэтому не подвергаются такому воздействию как рыбы. Кроме того, большая часть металлов, поступающих в наш пищеварительный тракт, будет нейтрализована связыванием с органическими веществами (частично переваренной пищей).
Рыба же постоянно подвергается воздействию любых металлов, присутствующих в воде. Тяжелые металлы просачиваются внутрь по путям для всасывания питательных веществ, особенно кальция. Таким образом рыбы, живущие в загрязненной металлами воде, будут накапливать их в организме, постепенно отравляясь.
Механизмы отравления тяжелыми металлами
Многие металлы ядовиты по причине того, что произвольно образуют связи с органическими молекулами в телах живых существ. Например, ртуть соединяется с сульфгидрильными группами (-SН), которые есть практически во всех белках, деактивируя тем самым их клеточные функции.
Отравление железом возникает как у растений, так и у людей (например, пациентов с гемофилией, перегруженных железом из-за частых переливаний крови [7, 8]). Отравление наступает, когда железо (Fе2+), окисляясь, производит высокореактивные радикалы кислорода, которые могут убить клетку, разрушив ее ДНК, мембранные липиды и белки.
Но наиболее распространенным механизмом отравления является процесс, когда инородный металл заменяет собой металл, который необходим организму находясь на своем месте в органической молекуле. Например, никель может вытеснить цинк с его места в ферменте карбоангидраза, тем самым деактивируя фермент [1]. Многим ферментам для надлежащего функционирования требуется присоединение определенного металла.
Замещение кальция тяжелыми металлами - частая причина отравлений. У всех клеточных мембран есть фосфолипидный бислой, стабилизированный кальцием. Элементы тяжелых металлов замещают кальций, разрушая структуру и функцию клеточной мембраны [1]. А так как кальций играет уникальную роль вторичного посредника в клетках, то многие функции почти всех живых организмов становятся восприимчивыми к действию токсичных тяжелых металлов [9, 10].
Отравляющее действие металлов на рыбЕсли слишком высокий уровень тяжелых металлов в воде приводит к разрушению тканей рыб и их гибели, то незначительные концентрации вызывают поведенческие изменения и репродуктивную недостаточность [11]. Поведенческие изменения - следствие того, что тяжелые металлы нарушают выработку нейромедиаторов и гормонов продуцирующими клетками [12].
После 4-х недельного воздействия свинца, у рыб появлялись проблемы с ловлей живых дафний.
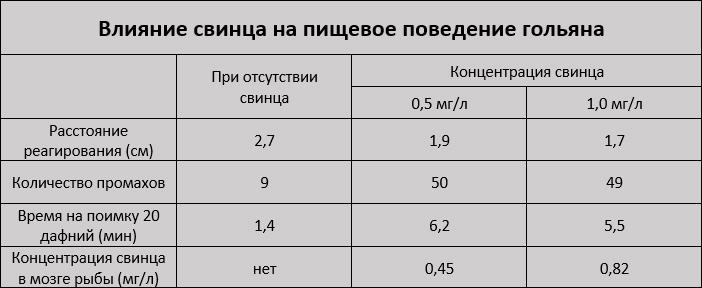
Контрольная (чистая) рыба реагировала на дафнию значительно раньше, чем зараженная свинцом. Кроме того, свинец накапливался в мозге зараженной рыбы.
Невысокие уровни тяжелых металлов могут влиять на нормальное поведение рыбы: обучаемость, кормежку, плавание и успешный нерест. У радужной форели, например, от меди значительно нарушались плавательные способности [13], а постоянное воздействие алюминия снижало аппетит и скорость роста молодняка [14]. Свинец не влиял на рост молодых самцов форели, но сильно воздействовал на выработку молок [15]. Обнаружилось ослабление необходимых для восходящей миграции запаховых рецепторов лосося из-за воздействия меди [16].
Суточные ритмы рыб управляются специальными нейромедиаторами мозга. Разрушая их, тяжелые металлы нарушают суточный ритм [12]. Например, когда морские сомы подвергались воздействию меди в концентрации 0,1 ppm, они теряли свой суточный ритм и становились гиперактивными. То есть зараженные сомы сохраняли активность как днем, так и ночью, а не зараженные были менее активны в течение дня, особенно в полдень.
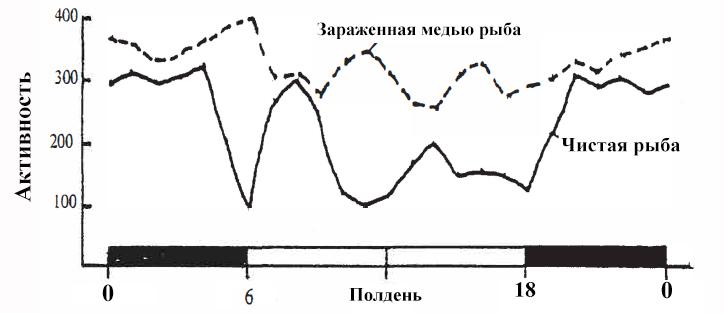
Суточная активность морского сома под влиянием меди. Сомы подвергались воздействию меди в концентрации 0.1 мг/л в течении 3 дней. Затем, в течение 24 часов мониторилась их активность. Активность регистрировалась с помощью фотодиодов, установленных между отсеками.
Рыба наиболее уязвима к тяжелым металлам на этапе своего развития. Например, у эмбрионов, подвергавшихся воздействию всего 0,3 ppm цинка, мембрана желточного мешка становилась очень хрупкой и легко разрывалась [19].
Отравляющее действие металлов на растения
Отравления растений тяжелыми металлами демонстрируют симптомы, которые могут быть неправильно истолкованы, как нехватка питательных веществ. У валлиснерии под воздействием алюминия наблюдается преждевременное старение и некроз кончиков листьев [22]. Избыток меди, марганца и цинка могут вызвать дефицит железа и хлороз [23].
Исследователи сообщают о 75% снижении роста рдеста, в следствии добавления железа в субстрат в концентрации FеCl31,2 мг/галлон [24]. Листья становились коричневыми, а корни бледными или красно-коричневыми и не доходили до дна горшков в которые были посажены. В колодезной воде с содержанием 1,2 ppm железа гидрилла мутовчатая (Hydrilla verticillata) становилась ржаво-коричневого цвета, загнивала и разрушалась [24].
В:
Чтобы уменьшить количество фосфатов в аквариуме, я добавил в воду железо в форме FeCl3. (Фосфор вступает в реакцию с железом, образовывая нерастворимый фосфат железа). Через 6 дней уровень фосфатов понизился с 0,6 ppm до 0,1 ppm, но также у некоторых растений стали проявляться симптомы дефицита фосфора. Сначала они появились у медленно растущих растений. Например, у криптокорин листья покрылись коричневыми пятнами, которые прогрессировали, пока не заняли всю площадь листа.
Недостаток фосфора не отразился на быстрорастущих видах, что меня удивило, так как они обычно нуждаются в больших количествах питательных веществ.
О:
Боюсь, что вы приняли признаки отравления железом за симптомы дефицита фосфора. Уровень фосфатов в 0,1 ppm - более чем достаточен для роста растений. Коричневые пятна на листьях указывают на отравление железом. Коричневый цвет происходит из-за отложений железа, которые растение накапливает в листьях.
Тот факт, что быстрорастущие растения не выказали признаков "дефицита", подтверждает мое предположение о том, что проблема заключается в токсичности металла, а не в нехватке питательных веществ. У растений отравление металлами нивелируется быстрым ростом.
Факторы, уменьшающие токсичность металлов
Поскольку на токсичность металлов оказывают влияние многие другие факторы, то бывает сложно сказать, какая именно концентрация окажется опасной. Она может зависеть, а может и не зависеть от жесткости воды, pH, растворенной органики и конкретных видов растений. В основном, токсичность металлов снижается, когда металлы связываются с органическими веществами, частицами почвы или карбонатными ионами. Вероятность поглощения таких связанных металлов растениями или рыбами невелика.
а) жесткость и pH
Токсичность металлов представляет большую опасность в мягкой и кислой среде. Многих ученых побудили к исследованиям опасения подкисления природных водоемов кислотными дождями. Если кислотность воды в водоеме ниже 5,5, то такие тяжелые металлы, как алюминий, медь и цинк, растворяются водой из осадков.
Эксперименты показывают, что жесткость воды сама по себе влияет на токсичность металлов. Подвергнутая воздействию 1,5 ppm алюминия форель, в мягкой воде имела смертность 45% и только 10% в жесткой [14]. Дафния жила менее 10 дней в мягкой воде с концентрацией цинка 0,13 мг/л и более 50 дней в воде средней жесткости [26].
Токсичность меди (Cu2+) в жесткой воде может снизиться до 90% из-за того, что она будет конкурировать с кальцием (Ca2+) за поглощение рыбами [27].
Прим. Рыба получает большую часть необходимого ей кальция, поглощая его из воды через кожу и жабры, а не в результате усваивания пищи в кишечнике [28, 29]. И карп, и форель легко извлекают кальций из воды, содержащей 5 - 20 ppm Ca [30].
Исследователи обнаружили, что при увеличении содержания кальция в воде с 4,4 до 43 ppm, поглощение тяжелых металлов (и отравляющее действие) у мидий сильно снижалось [9]. Оказалось, что кальций значительно важнее магния в деле предотвращения поглощения металлов. Исследователи предположили, что конкуренция кальция с тяжелыми металлами за проникновение в клетку через кальциевые каналы является основным механизмом защитного действия жесткой воды.
Кислотность не сильно, но тоже влияет на токсичность металлов, при этом нейтральный рН обеспечивает максимальную защиту. Таким образом, для радужной форели, при понижении pH с 7,2 до 5,4, медь оказывалась в два раза токсичней [27]. Особенно сильно кислотность действует на алюминий. Он токсичен только в чрезвычайно кислой рН < 5,5 или щелочной рН > 8 воде. В целом же, металлы будут более токсичными в мягкой, кислой воде и менее токсичны в жесткой, щелочной.
В.
У меня в аквариуме стоит алюминиевый отражатель, с которого может капать в воду конденсат. Мне надо беспокоиться о токсичности этого алюминиевого конденсата?
О.
Нет. Если вода у вас в аквариуме имеет рН от 6,0 до 8,0, алюминий не токсичен.
б) растворенный органический углерод
Жесткость и кислотность воды могут снижать токсичность металлов, но органический углерод делает это лучше [14]. В опытах над флоридской джорданеллой (Jordanella floridae), исследователи выяснили, что органический углерод обеспечивает в 27 раз большую защиту, чем жесткость воды [31].
В реках и озерах концентрация растворенного органического углерода (РОУ) довольно высока: 1 - 30мг/л (в среднем 6 мг/л)[32]. Он хоть и может немного придавать воде оттенок, но в основном невидим, за исключением мыльной пены, образовывающейся в потоках и течениях воды (аквариумных протеиновых скиммерах).
Металлы легко образовывают связи с РОУ. Каждый мг РОУ обладает способностью связывать 1 мкэкв (микроэквивалент) металла [33]. Связанные металлы трудно поглощаются и, следовательно, гораздо менее токсичны, чем растворенные металлы [34].
Прим. Не все металлы, связанные органическими веществами становятся менее токсичными. Если органическое вещество является гидрофобным (т.е. растворяется в жирах, но не растворяется в воде), оно может действовать как "ионофор", перенося металл в клетку через липидный бислой. Например, ртуть, связанная с метильными группами, значительно увеличивает свою токсичность [2].
Вот примеры РОУ, которые связывают металлы: аминокислоты (глицин, аланин и т.д.), сахара (малат, цитрат и т.д.), полепептиды, белки и гуминовые вещества.
Прим. Гуминовые вещества - группа веществ специфической природы, образующихся в почве из отмерших растительных и животных организмов в результате биологических и биохимических превращений в условиях ограниченного доступа воздуха. (Большая Медицинская Энциклопедия)
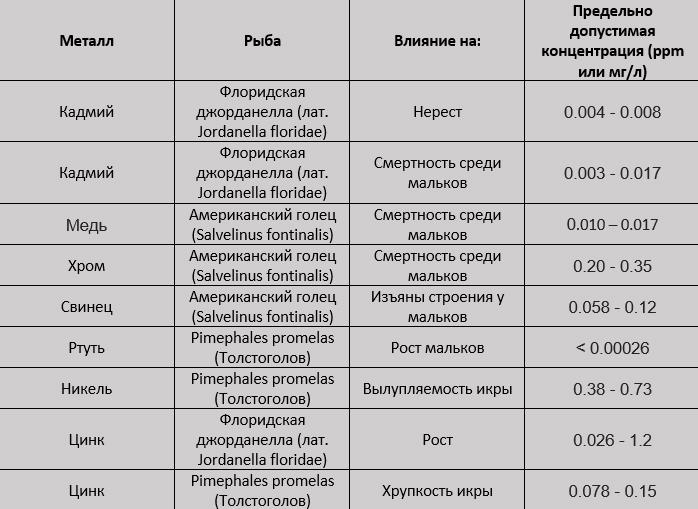
На рисунке показан пример того, как 3 органических соединения (глицин и два гуминовых соединения) связывают медь (Cu).
Пример связей меди (Сu) с органическим углеродом.
Гуминовые вещества образуют более крепкие связи с тяжелыми металлами, чем кальций [9]. Это означает, что они уменьшают токсичность металлов даже если вода жесткая и содержит много кальция (Ca).
Несколько исследований показали, что РОУ (или его компонент гуминовой кислоты) снижает токсичность металлов. Например, когда из воды озера путем фильтрации через угольный фильтр был удален естественный РОУ, то токсичное воздействие меди (4-х дневная ЛД50) на гольянов увеличилось в 10 раз [36].
Прим. ЛД50 — средняя доза вещества, вызывающая гибель половины членов испытуемой группы.
В другом исследовании, под воздействием меди в концентрации 0,015 ppm в течение 24 - 48 ч. погибло большинство дафний, но когда было добавлено 1,5 ppm гуминовой кислоты, дафнии выживали в течение 40 дней [37]. Радужная форель, в течение продолжительного времени подвергавшаяся воздействию 0,1 ppm растворимого алюминия не только не погибала, но и росла примерно на 40% быстрее в присутствии гуминовой кислоты [14].
Исследователями изучалось влияние РОУ на токсичные растворы алюминия, цинка и меди, воздействующие на флоридскую джорданеллу в мягкой кислой воде [31]. (Концентрации этих металлов зачастую увеличиваются при закислении озер). Смертность среди рыб от смеси металлов снизилась в 2 - 15 раз благодаря озерному РОУ. Исследователи пришли к выводу, что молодь флоридской джорданеллы, вероятно, не могла выживать в подкисленной мягкой воде, содержащей менее 2,2 мг/л общего органического углерода.
Связывание металла с РОУ (или его компонентом гуминового вещества) предотвращает поглощение металлов организмами. Это верно как для растений, так и для рыб. Один исследователь в своей работе (см. таблицу) показал, что водный гиацинт не поглощал медь (Cu) в присутствии гуминовой кислоты.

Эффект воздействия гуминовой кислоты на поглощение меди водяным гиацинтом [38]. Растения росли в 4-х литрах питательной среды, содержащей медь (Cu), в течение 1 - 2 недель с 20 ppm гуминовой кислоты или без таковой.
Искусственные хелаторы
Искусственные хелаторы крепко связывают тяжелые металлы. В отличие от РОУ, они связывают металлы в молярном соотношении один к одному с хорошо известным порядком приоритета [39]. Например, было показано, что каждая молекула ЭДТА связывает одну молекулу меди с высокой степенью предсказуемости [38]. В таблице показаны константы устойчивости для образования некоторых комплексов металлов с ЭДТА:

Стабильность комплексов металл - ЭДТА [40]. (Здесь хоть и не показан, но комплекс медь - ЭДТА имеет почти такую же стабильность, как и комплекс цинк - ЭДТА [41].
Они перечислены в порядке возрастания прочности связывания, причем трехвалентное железо является наиболее прочно связанным, а магний - наименее. К счастью ЭДТА связывает тяжелые металлы, такие как Zn и Fe, гораздо прочнее, чем Ca и Mg. Zn, например, ЭДТА связывает в 790000 раз прочнее, чем Ca.
Прим. Log K для цинка (17,8) минус Log K для кальция (11,9) = 5,9. Антилогарифм 5,9 (например, 105.9) составляет 790 000.
Металлы могут поменяться местами с металлами молекулы ЭДТА [41]. (Так Ca может быть выбит цинком (Zn) со своего места в молекуле ЭДТА, так как Zn образует более прочную связь с молекулой ЭДТА, чем Ca). Таким образом, даже если ЭДТА в жесткой воде уже связан с Ca и Mg, она все равно обладает способностью к снижению токсичности тяжелых металлов.
В.
Снизит ли хелатное удобрение (Fe - ЭДТА) токсичность металлов для рыб?
О.
Нет. В данном случае ЭДТА уже связана с металлом Fe. А так как железо образует наиболее прочную связь с ЭДТА, то у других металлов, таких, например, как цинк или медь нет шансов занять его место. Только если вы внесете чистую ЭДТА, она сможет удалить цинк, медь или другие токсичные металлы. (Продаваемые аквариумные кондиционеры для воды, часто имеют в своем составе ЭДТА).
В.
Не понимаю - многие растениеводы используют хелатированное железо в качестве удобрений, но если железо образовывает такие крепкие связи с ЭДТА, то как тогда растения его извлекают?
О.
Под воздействием света железо медленно освобождается из ЭДТА. Этот процесс, который также применим и к железу, связанному с РОУ, делает его доступным для растений.
Различия между видами
Изменения видов в ответ на отравления металлами закрепляются на генетическом уровне. Виды, которые более чувствительны к токсичности металлов не легко становятся устойчивыми к ним. Например, один сорт наземной травы в конечном итоге адаптировался к загрязненной свинцом почве, но на это потребовалось около 100 лет [42].
Одним из способов защиты растений является выработка собственных хелаторов металлов [43]. Например, было обнаружено, что при воздействии увеличивающегося количества Al, устойчивый к нему сорт пшеницы высвобождает больше хелатирующего малата из кончиков корней, чем сорт чувствительный к алюминию.
Виды растений и рыб, которые в ходе своей эволюции развивались в жестких щелочных водах мало подвергались воздействию тяжелых металлов. Как следствие, эти организмы не выработали физиологических механизмов, которые защитили бы их от отравления металлами.
Реплика: я долгое время испытывала трудности с содержанием радужниц и танганьикских цихлид. Когда я делала подмену воды, они необъяснимо гибли, а на тетр это никак не влияло. Также мне очень не везло в выращивании мальков в моей воде. Вдобавок, у меня были проблемы с выращиванием таких растений "для начинающих" как валлиснерия, саггитария и роголистник, однако не было проблем с криптокоринами. Позже я узнала, что в моей водопроводной воде концентрация меди иногда доходила почти до 2 ppm.
Ответ: рыбы и растения, которые гибли от меди в вашей водопроводной воде, имеют происхождение из водоемов с жесткой водой. Как следствие, они более чувствительны к воздействию тяжелых металлов, чем тетры и криптокорины, которые происходят из водоемов с мягкой, кисловатой водой.
Другие факторы
Рост сам по себе может снизить или устранить токсичность металла просто «разбавляя» его концентрацию в тканях органов. Например, токсичность алюминия и железа, которая препятствует размножению валлиснерии американской в кислых озерах можно устранить, стимулируя рост растения с помощью CO2 - это снизило концентрацию алюминия с 2000 ppm до 693 ppm [45].
Частицы почвы легко связывают тяжелые металлы. Исследователи, анализирующие взаимодействие тяжелых металлов с частичками почвы в двух ручьях Южной Каролины обнаружили, что свинец (Pb) тесно связан с более крупными частицами почвы, особенно с глиной.
Поглощение металлов растениями
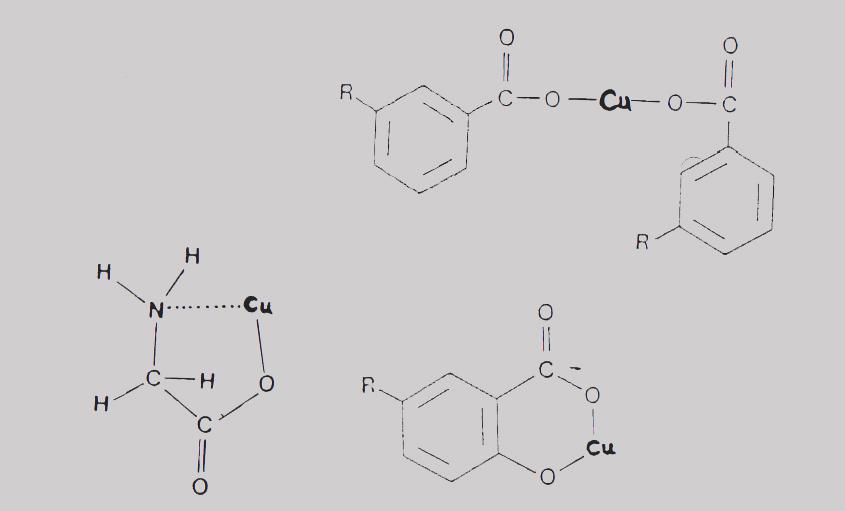
Водные растения легко поглощают тяжелые металлы. Например, листья и корни элодеи натталля (Elodea nuttallii) быстро поглощали медь и цинк:
Поглощение Cu и Zn листьями и корнями элодеи натталля (Elodea nuttallii). Части листьев или корней подвергали воздействию Cu или Zn (3,2 ppm) и затем анализировали на предмет накопления металлов в пересчете на сухой вес.
Поглощение металлов корнями происходило особенно быстро. Так в течение 2 часов корни, подвергшиеся воздействию 3,2 ppm цинка, накапливали более 1000 мг/кг цинка, в то время как листья накапливали около 300 мг/кг.
Поглощение металла является пассивным процессом в том смысле, что накопление увеличивается прямо пропорционально концентрации металла в питательном растворе [49]. Кроме того, поглощение металлов растениями имеет мало общего с потребностями их в питательных веществах. Гидрилла мутовчатая (Hydrilla verticillata) не переставала насыщаться железом до тех пор, пока уровень хелатного железа в воде не достиг 6 мг/л, а ее ткани не стали содержать более 21 000 мг/кг железа [50]. [Замечание: критическая концентрация для железа составляет всего 60 мг/кг.] Кроме того, было показано, что водяной гиацинт, который особенно устойчив к токсичности металлов, удаляет практически всю медь из концентрированных ее растворов (1 и 10 мг/л) в течение от 1 до 3 недель без какого-либо видимого вреда для себя [38].
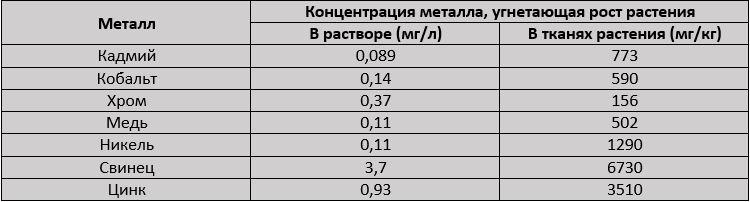
Поглощение металлов ряской многокоренной (Spirodela polyrrhiza) [51]. Концентрацию металла в питательной среде и в растениях, у которых наблюдалось 50% угнетение роста (EC50), рассчитывали после воздействия на 10 растений 5 - 6 различных концентраций металлов в течение 4 дней.
В таблице задокументирована работа с ряской Spirodela polyrhiza, выявившая соотношение угнетающего металла с его количеством в тканях растения. Рост растений, выращенных в растворах, содержащих 3,7 мг/л Pb, замедляется на 50%, а ткани растения содержат более 6700 ppm свинца.
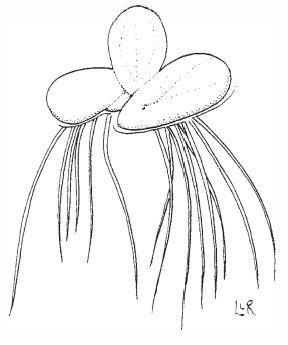
Ряска многокоренная (Spirodela polyrrhiza). Как и многие другие водные растения, может быстро удалять большие количества тяжелых металлов из загрязненной воды. Это растение почти в 3 раза больше обычной ряски (Lemna minor). Рисунок взят из IFAS [52].
Аммиак
Аммиак является одним из наиболее важных и распространенных загрязнителей аквариумной воды. Рыбы и бактерии выделяют аммиак, как отходы жизнедеятельности. Токсичный аммиак (NH3) существует в равновесии с нетоксичным аммонием () в соответствии с уравнением химической реакции:
NH3 + H2O <=> NH4OH <=> + OH-
Процентное содержание аммиака в растворе с заданной концентрацией N резко изменяется в зависимости от pH. Как правило, на каждое повышение pH на 1, концентрация аммиака увеличивается в 10 раз, поскольку превращается в NH3 согласно вышеуказанному уравнению. Например, если рН увеличивается с 7,0 до 8,0, то процент азота, который представляет собой NH3, увеличивается примерно с 0,33% до 3,3%, в то время как процент азота, который представляет собой NH4+, соответственно падает с 99,7% до 96,7% [53]. Таким образом, чем выше pH, тем выше концентрация NH3 и, соответственно, выше токсичность данной концентрации неорганического азота.
Токсичность аммиака для рыб
Рыбы различаются по восприимчивости к аммиаку. Например, было обнаружено, что летальные концентрации аммиака для радужной форели варьируются от 0,2 до 1,1 мг/л NH3, тогда как концентрации для менее уязвимого канального сомика составляют от 1,8 до 3,8 мг/л NH3 [54].
Хроническое воздействие аммиака ухудшает размножение (например, задерживает нерест и снижает жизнеспособность икринок). Длительное (от 1 недели до 3 месяцев) воздействие аммиака в концентрациях от 0,002 до 0,15 мг/л NH3 может подавлять аппетит и препятствовать росту молоди рыб [54]. Другими симптомами могут стать рваные плавники или уродства у молодой рыбы, такие как отсутствие жаберных крышек или рыба может просто становиться все более восприимчивой к болезням.
Рекомендации по безопасному уровню аммиака разнятся. В естественных пресных водоемах, чтобы избежать хронического воздействия, эксперты по качеству воды рекомендуют поддерживать уровень аммиака (NH3) ниже 0,01 мг/л. Аквариумисты, которые с помощью своих тестовых наборов измеряют уровень общего аммиака (NH3 плюс NH4+) должны поддерживать уровень общего аммиака ниже 0,02 мг/л [56].
Токсичность аммиака для растений
Аммиак способен замедлить рост или даже убить растения [57]. Даже в пределах одного и того же рода водные растения различаются по своей способности переносить аммиак. Например, элодея канадская (Elodea canadensis) показала небольшое (-20%) снижение фотосинтеза при воздействии 3,2 мг/л NH4+ в течение 7 дней при pH, равном 8,4.
Прим. При рН 8,4 около 15% этого аммония (NH4) будет существовать в форме аммиака (NH3) [56].
А на рост элодеи натталля (Elodea nuttallii) и Elodea ernstae концентрация NH4+, равная 9,6 мг/л, не повлияла, или даже наоборот, стимулировала его [58].
Другие исследования показывают, что при концентрации NH4+, равной 5,0 мг/л, рост рдеста густого (Potamogeton densus) замедляется, тогда как у телореза алоэвидного (Stratiotes aloides) при воздействии всего лишь 0,9 мг/л NH4+ в течение 10 недель наблюдается разрушение растительных тканей [59]. Высокие концентрации (от 2,6 до 26 мг/л) NH4+ не угнетали рост сальвинии молеста (Salvinia Molesta), а в некоторых случаях стимулировали его [60].
Таким образом, похоже, что чувствительным к аммиаку видам будет нанесен вред концентрацией NH4+, равной уже около 1 мг/л. Однако менее чувствительные водные растения, особенно те, которые приспособлены к богатой питательными веществами воде, не пострадают от концентраций до 26 мг/л NH4+.
Растения быстро устраняют аммиак [61]. Когда NH3 поступает в клетку путем простой диффузии через мембрану, он может соединяться с ионом водорода (H+) и превращаться в нетоксичный аммоний (NH4+) [62]. Этот NH4+ может храниться в клеточных вакуолях. Действительно, было обнаружено, что вакуоли Nitella clavata содержат более 2400 мг/л NH4+ [64].
Другим способом нейтрализации растениями аммиака является немедленное его использование для синтеза белков. Токсичный NH3, соединяясь с запасенными углеводами, образует обычные аминокислоты. Таким образом, растения, которые хорошо растут, могут переносить большие концентрации аммиака, потому что в них содержится больше углеводов для соединения с ним.
В.
Есть ли доказательства того, что растения в аквариуме поглощают аммиак (NH3)?
О.
Нет точных доказательств того, что аммиак, как таковой, активно поглощается растениями. Однако аммиак свободно диффундирует через клеточные мембраны всех организмов (животных, растений, бактерий, рыб и т. д.), а аммоний - нет (62). Эта ситуация может быть аналогична СО2 и бикарбонату. NH3 и CO2 - нейтральные газы без электрического заряда свободно диффундируют в растительные клетки. Напротив, бикарбонат (HCO3-) и аммоний (NH4+) оба имеют электрический заряд и не могут свободно диффундировать в клетку. Их поглощение требует затрат энергии и материалов (мембранные транспортеры, ферменты и т. д.), что снижает вероятность их поглощения растениями.
Действительно, токсичность небольших, незаряженных молекул, таких как NH3, HN02, C02 и H2S могут быть частично обусловлены тем фактом, что клетки зачастую не могут удерживать эти молекулы и/или регулировать их поглощение. Поэтому все организмы уязвимы для этих молекул, если их концентрации достаточно высоки.
Поглощение аммиака водными растениями
Большинство исследованных водных растений, когда им предоставляется выбор между аммонием и нитратами в качестве источника азота, поглощают исключительно аммоний. Только когда аммоний недоступен, растения поглощают нитраты.
Нитриты
Аквариумисты меньше обсуждают проблемы с нитритами, чем с аммиаком. Однако в пресноводных аквариумах нитриты иногда могут стать причиной проблем.
Поскольку нитриты образуются в результате некоторых процессов бактериальной деятельности, то случаи их накопления не являются редкостью. Сообщалось, что в загрязненных природных водах уровни нитритов достигают 100 мг/л N02 [54].
Прим. Нитриты часто определяют количественно как нитритный азот (то есть NO2-N). Поскольку NO2- это 30% N, 100 мг/л NO2- эквивалентно 30 мг/л NO2-N.
Токсичность нитритов
Кислород в организме переносится содержащимися в крови молекулами гемоглобина. Нитриты превращают гемоглобин в метгемоглобин, который представляет собой молекулу коричневого цвета, которая не может связываться с кислородом. Гемоглобин у рыб может превращаться в метгемоглобин, при концентрации нитритов в воде всего лишь 0,05 мг/л [54].
На разные виды рыб нитриты влияют по разному. Так для радужной форели летальные концентрации колеблются от 0,1 до 0,4 мг/л NO2-N, для гамбузии обыкновенной (Mosquito fish) до 1,6 мг/л и для канального сомика 10 мг/л [54]. При указанных дозах наблюдалась гибель половины популяции рыб за 3 дня. Как и в случаях отравления любыми токсинами, более низкие концентрации могут не убить рыбу, но вызвать у нее стресс, так что в конечном итоге она поддается болезни или у нее возникают другие проблемы. Например, у лосося стальноголового (Steelhead Trout), подвергавшегося воздействию низких концентраций NO2-N (от 0,015 до 0,060 мг/л) в течение 6 месяцев, наблюдалось временное (но не постоянное) повреждение жабр [54].
Нитриты (NO2-) более токсичны при низких значениях pH, поскольку превращаются в азотистую кислоту (HNO2), которая является токсичной формой нитритов [65]. Кроме того, токсичность нитритов резко снижается с увеличением концентрации соли (NaCl), поскольку Cl- конкурирует непосредственно с NO2- за поглощение жабрами рыб [66]. Так отравляющее воздействие 12 мг/л NO2-N на радужную форель было снижено на 96% путем простого повышения концентрации Cl- с 1 до 41 мг/л. Неудивительно, что нитриты не токсичны в соленой воде [67], где концентрация Cl- составляет 19000 мг/л [34].
Эксперименты с радужной форелью [66], которая особенно чувствительна к нитритам, показали, что аквариумисты должны поддерживать уровень нитритов ниже 0,01 мг/л NO2-N.
Для растений нитриты гораздо менее токсичны, чем для рыб. Например, исследователи использовали питательные среды, содержащие от 14 до 56 мг/л NO2-N, для изучения поглощения и усвоения нитритов ряской [68,69]. Относительная нетоксичность нитритов для растений подтверждается работой с наземными растениями. Так одно исследование показало, что рост ростков пшеницы лишь незначительно замедлялся, когда концентрации нитритов достигали 70 мг/л [70].
В.
Почему у золотой рыбки в холодную погоду появляются коричневые полосы?
О.
Коричневые полосы на плавниках означают отравление нитритами. Летом, когда водоросли и растения растут хорошо, рыба тоже чувствует себя прекрасно. Зимой же рост растений и водорослей замедляется и в воде остается больше азота. Кроме того, в холодную погоду нитрификация часто бывает неполной, и нитриты имеют тенденцию накапливаться.
Я бы в таком случае немедленно сделала подмену воды и убрала мусор. Также добавила бы по одной чайной ложке обычной пищевой соли на каждый галлон прудовой воды. (Стандартным методом лечения отравления нитритами является добавление соли из расчета 20 мг/л NaCl на каждый 1 мг/л NO2-N [63].) Вообще-то неплохо было бы контролировать уровень нитритов в своем пруду, особенно зимой.
Поглощение нитритов растениями
Хотя растения определенно могут использовать нитриты в качестве источника азота, актуальный вопрос для аквариумистов состоит в том, что будет первым удаляться из воды водными растениями - токсичные нитриты или нетоксичные нитраты? В настоящее время в научной литературе однозначного ответа на этот вопрос нет. Но когда ряска Spirodela oligorrhiza выращивалась в средах, содержащих нитриты и нитраты, она явно предпочитала нитриты:
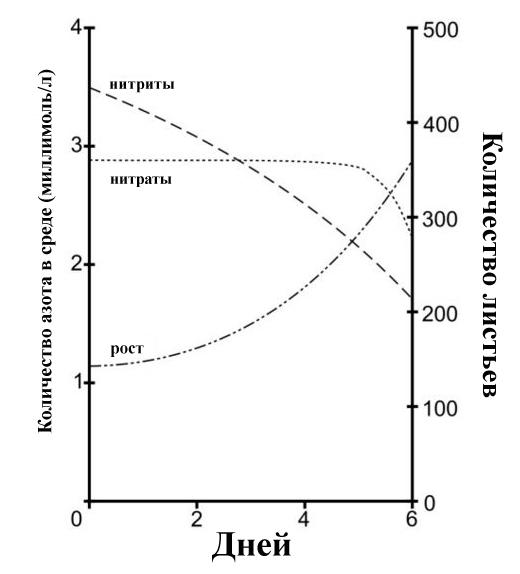
Поглощение нитритов (NO2-) и нитратов (NO3-) ряской Spirodela oligorrhiza. Растения, которые выращивались с аммонием в качестве единственного источника N, были перенесены в среду, содержащую как нитриты, так и нитраты. Их растили в стерильных условиях. (Таким образом, вышеуказанные изменения уровней нитритов и нитратов не могли быть вызваны бактериальными процессами.)
Когда тот же исследователь выращивал Spirodela oligorrhiza в средах, содержащих аммоний и нитриты, удалялись оба иона примерно с одинаковой скоростью. Эти результаты показывают, что водные растения в равной степени предпочитают аммоний и нитриты нитратам. Однако, вероятно результаты с Spirudela oligorrhiza, не могут быть обобщены для других водных растений. Это связано с тем, что для поглощения и усвоения нитритов белками требуются специфические транспортеры и ферменты, а для поглощения аммония - нет [70]. Например, фермент нитритредуктаза, необходимый для того, чтобы ряска малая (Lemna minor) могла использовать нитриты, должен быть ею выработан [69]. Его выработка может быть заблокирована аммонием, что позволяет предположить, что L. minor является одним из тех видов водных растений, которые не использует нитриты, если имеется аммоний. В общем, нитриты и нитраты для растений являются менее желательными источниками азота, чем аммоний.
Использование водных растений для очистки сточных вод
В.
Если водные растения настолько хороши в удалении токсичных металлов и аммиака из воды, то почему особо не растет их использование для очистки сточных вод?
О.
Проблема заключается в том, что очистка воды водными растениями требует больших площадей для прудов, круглогодичных тропических температур и постоянного (и часто дорогостоящего) сбора растений [71].
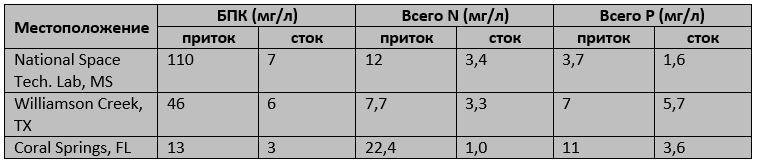
Благодаря высокой скорости роста, для очистки сточных вод используется водяной гиацинт (Water hyacinth). В таблице показана производительность некоторых систем очистки сточных вод, использующих водяной гиацинт:
Эффективность водяного гиацинта в очистке сточных вод. БПК (биологическая потребность в кислороде) - это показатель качества воды. Чем больше органических веществ в воде, тем больше кислорода потребуется бактериям для их переработки. У чистой воды более низкая БПК, чем у загрязненной.
Растения были особенно эффективны на предприятии в Корал-Спрингс, где общий азот был снижен с 22,4 мг/л до 1,0 мг/л.
Водяной гиацинт (Eichhomia crassipes). E. crassipes - одно из многих плавающих растений, использущихся для очистки сточных вод. Его высокая скорость роста, из-за которой водяной гиацинт становится основной бедой для навигации по водным путям, также делает его очень эффективным в удалении загрязнителей воды. Для большинства аквариумов он слишком велик, но существуют и другие плавающие растения по своим размерам более подходящие для содержания в аквариумах (ряска, водяной салат, папоротник индийский) и также обладающие огромными способностями очищать воду. Это потому, что все плавающие растения обладают преимуществом воздушной среды обитания.
Ряска горбатая (Lemna gibba) также оказалась высокоэффективной в удалении аммиака, выделяемого рыбами, особенно в присутствии циркуляции воды:
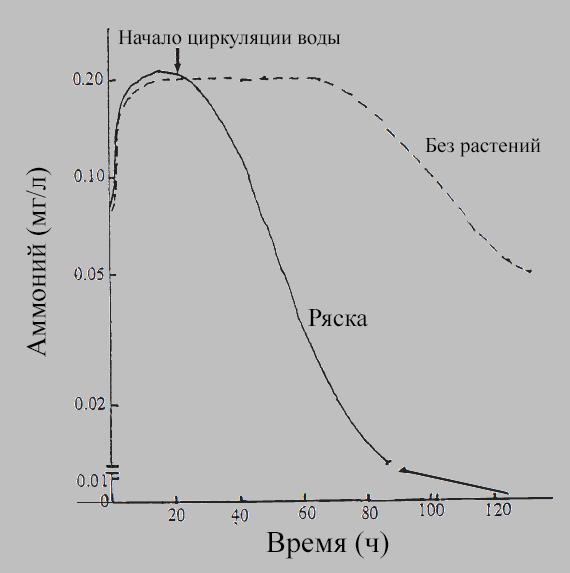
Уровни аммиака, выделяемого рыбами, в прудах с ряской и без нее. Вода с выделениями рыб и одинаковыми уровнями нитратов и аммония (0,08 миллимоль каждого) была взята из большого резервуара, в котором содержали тилапию. В перерасчете на мг/л это будет 5,0 мг/л NO3 и 1,4 мг/л NH4.
Растения и токсичные соединения в аквариумах
В моем собственном колодце вода содержит небольшой, вероятно, безвредный уровень меди (0,05 ppm ), но достаточно цинка (0,8 ppm ), чтобы иногда вызывать проблемы в моих аквариумах. Например, когда в одном из резервуаров я сделала большую подмену воды сырой водой из-под крана, то креветки забеспокоились и сновали туда-сюда. Я спасла двух креветок, немедленно переместив их в другой аквариум, но третья креветка, которую я не смогла поймать, умерла на следующее утро. Также, в последующие несколько дней заболели некоторые гуппешки.
Растения также пострадали. Эхинодорусы амазонские (Echinodorus amazonicus) побледнели и содержали очень высокий уровень цинка. А когда я кладу эгерию густолиственную (Egeria densa) в чистую водопроводную воду, растения быстро коричневеют и загнивают. (Такие же симптомы я наблюдала в эксперименте, в котором выращивала растения в питательной среде, содержащей 1 ppm цинка.) Когда я выращивала альтернантеру (Altemanthera) в почве с высокой концентрацией марганца, рост замедлялся, а листья морщились и деформировались.
Некоторые кондиционеры для аквариумной воды содержат хелатор металлов EDTA, который довольно эффективно противодействует токсичности металлов. Например, мне удалось полностью нейтрализов




***
Комментарии: