Диана Вальштад. Углерод
Diana L. Walstad "Ecology Of The Planted Aquarium"
Углекислый газ (CO2) для растений - это больше, чем просто питательное вещество. В своей бикарбонатной форме (HCO3-) он также является основным pH-буфером природных пресных вод.
 Заштрихованные прямоугольники представляют собой участки плотных зарослей роголистника в пруду. Измерения проводились на 50-метровом разрезе пруда Сангвин летним днем (июнь).
Заштрихованные прямоугольники представляют собой участки плотных зарослей роголистника в пруду. Измерения проводились на 50-метровом разрезе пруда Сангвин летним днем (июнь).
 Hydrilla verticillata, сильный конкурент.
Hydrilla verticillata, сильный конкурент.
Щелочность, pH и CO2
Для большинства природных пресных вод щелочность определяется в основном концентрацией бикарбоната в воде.
Щелочность строго определяется как миллиэквиваленты (мэкв.) кислоты, необходимые для сдвига pH воды в щелочную сторону от нейтральной. Хотя на щелочность могут влиять другие ионы (силикаты, фосфаты, бораты и т. д.), но обычно большую часть щелочности определяет концентрация бикарбоната в воде [1]. Многие станции водоподготовки выражают щелочность как ppm CaCO3 с 1 мэкв H2CO, что эквивалентно щелочности 50 ppm CaCO3. Однако аквариумные наборы тестов обычно определяют ее как KH (немецкая степень карбонатной жесткости). Один KH равен 17,9 ppm щелочности CaCO3.
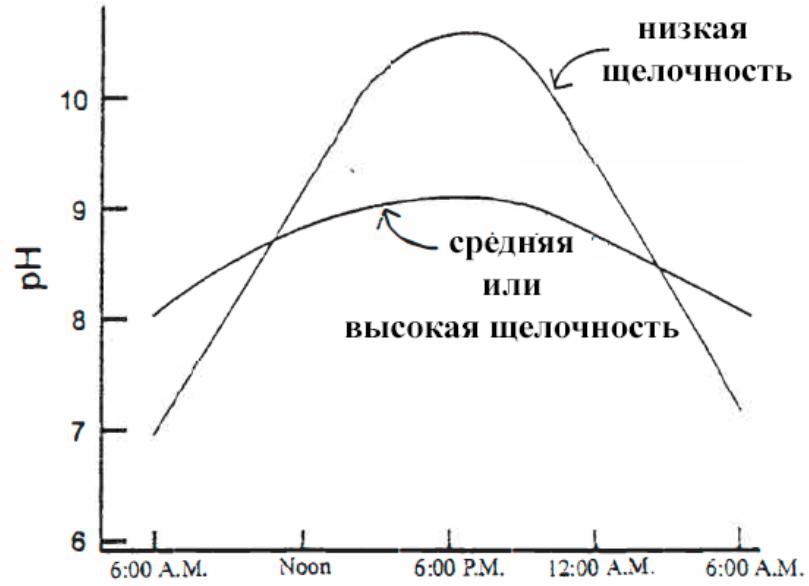
Чем больше бикарбонатов, тем выше щелочность, а значит, больше буферизация pH. На рис. VI-1 показано, как щелочность сдерживает большие дневные изменения pH в прудах рыбохозяйств.
рис. VI-1 Влияние щелочности на ежедневные изменения pH в прудах рыборазводческих хозяйств.

Низкая щелочность была определена как менее 20 (в ppm CaCO3). Умеренная или высокая щелочность была 50-300.
В прудах с низкой щелочностью наблюдается значительное повышение pH во второй половине дня из-за фотосинтеза. Пруды с умеренной или высокой щелочностью демонстрируют гораздо меньшие изменения pH.
Буферное действие щелочности основано на следующих реакциях равновесия растворенного неорганического углерода (РНУ):
CO2 + H20 <=> H2CO3 <=> H+ + HCO3- <=> CO32- + 2H+
Когда уровни CO2 или H+ меняются, большая часть этого изменения поглощается бикарбонатом (HCO3-). Например, когда в воде образуется кислота (H+), скажем, во время нитрификации, часть этого H+ соединяется с HCO3-. Таким образом, несмотря на добавление в воду H+, pH не может сразу снизиться.
Приведенная выше реакция также показывает взаимосвязь между pH и CO2. Так, когда в воду добавляется CO2, например, во время продувки углекислым газом, указанная выше реакция сдвигается вправо и образуется H+ (кислота), а pH имеет тенденцию к снижению. (Скорость понижения pH зависит от щелочности воды.) И наоборот, когда CO2 удаляется из воды, например, во время фотосинтеза или смешивания воды с воздухом, реакция сдвигается влево. В результате расходуется H+, а pH стремится к повышению. Опять же, скорость повышения pH зависит от щелочности воды.
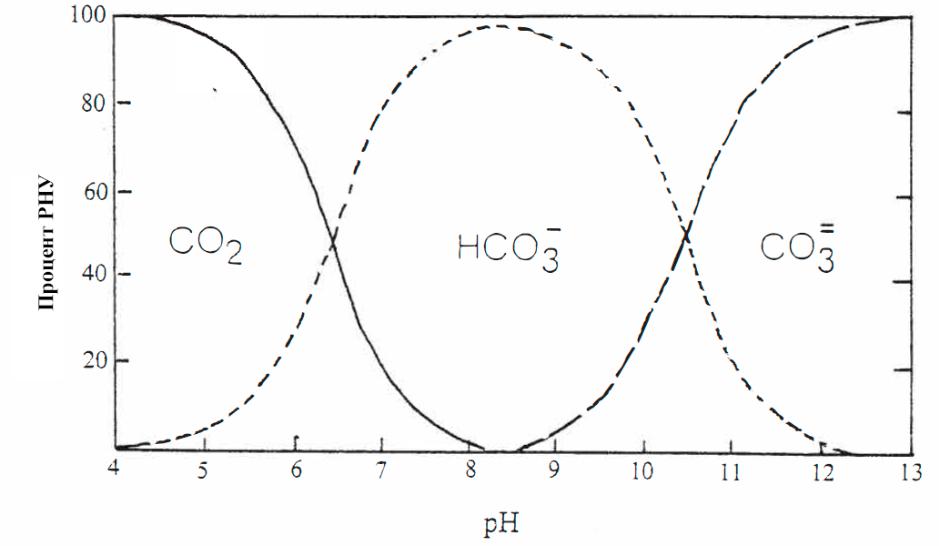
Не только CO2 влияет на pH, но и pH влияет на концентрацию CO2. Для pH определяются относительные пропорции CO2, бикарбонатов (HCO3-) и карбонатов (CO32-) (Рис. VI-2).
Рис. VI-2 Влияние pH на относительные пропорции CO2, бикарбонатов и карбонатов.

При кислом pH от 5 и ниже большая часть растворенного неорганического углерода (РНУ) воды составляет CO2. При pH 6.5 вода содержит примерно равное количество CO2 и бикарбоната, а при pH 8.5 почти весь CO2 превращается в бикарбонаты. Когда вода достигает pH 10, около 24% бикарбонатов, в свою очередь, превращаются в карбонаты.
Щелочность представляет собой законсервированный углерод для растений. Ее сравнивают с «бикарбонатной батареей», которая накапливает C02 [4]. В течение дня растения используют батарею и расходуют бикарбонаты воды. Щелочность опускается. Ночью, наоборот, «аккумулятор» заряжается свежим CO2, полученным при дыхании растений, рыб и бактерий. Щелочность восстанавливается.
В. В магазине есть аквариум для растений на 40 галлонов (150 л). pH около 7,2. Используется только вода из обратного осмоса. Недавно я добавил в эту систему продувку C02, и, похоже, это положительно повлияло на растения. Однако визуальный тестер стал показывать, что в воде слишком много CO2. Я заменил рыб в этом аквариуме на дышащих ртом (гурами и петушки), потому что тетры крибенсис и конго задыхались на поверхности.
Мой вопрос: при таких условиях передозировка C02 опасна?
О. Ваша рыба находится в серьезной опасности.
Кстати, и для растений это может быть бесполезно. Исследования (5) показали, что внесение CO2 выше 50 мг/л угнетает фотосинтез Elodea densa. По-видимому, избыток CO2 снижает обычно щелочной pH в клетках растений, так что основной фотосинтетический фермент растения (RUBISCO) перестает работать [6].
Добавление CO2 в воду из обратного осмоса может легко убить рыбу. (Осмосная вода почти не содержит солей, в том числе бикарбонатов, поэтому у нее не будет достаточной щелочности для буферизации дополнительного CO2.)
Если вы используете продувку CO2, вам просто нужно поддерживать определенную щелочность воды. Добавление жесткой водопроводной воды или пищевой соды - это способ повысить щелочность. Внесение одной из этих добавок, которое необходимо делать периодически, должно довести щелочность до нормального тестового уровня. Вода в вашем аквариуме должна иметь карбонатную жесткость (KH) выше 3 или 4.
Углерод - ограничивающий фактор роста погруженных растений
Водные растения в природе (и в аквариумах) часто ограничены в CO2. Считается, что трудности, с которыми погруженные растения сталкиваются в получении достаточного количества CO2, являются причиной их медленного роста и низкой продуктивности. Растения, растущие на воздухе (наземные, надводные, растения дождевых тропических лесов) намного более продуктивны, чем пресноводные погруженные растения.
Таблица VI-1. Продуктивность различных растений
| Тип растения (все тропические) | Продуктивность |
|---|---|
| Пресноводные погруженные растения | 1.7 |
| Пресноводные надводные растения | 7.5 |
| Морские погруженные растения | 3.5 |
| Наземные однолетние растения | 3.0 |
| Растения дождевых тропических лесов | 5.0 |
Из таблицы видно, что пресноводные надводные растения более чем в четыре раза продуктивнее, чем пресноводные погруженные растения - 7,5 против 1,7 кг.
Низкая продуктивность погруженных растений не связана с тем, что в воде меньше CO2, чем в воздухе. (В среднем в большинстве природных вод содержится примерно в три раза больше мг/л CO2, чем в воздухе [8,9]). Причина в том, что C02 очень медленно диффундирует в воде (в 10 000 раз медленнее, чем в воздухе). Это простое физическое явление неотвратимо ограничивает поглощение CO2, потому что молекулы газа просто не успевают контактировать с листом растения достаточно быстро, чтобы удовлетворить его потребности.
Но, если медленное движение CO2 в воде было бы единственной проблемой для погруженных растений, то морские растения должны были бы быть столь же непродуктивными, как и пресноводные. Однако таблица VI-1 показывает, что продуктивность погруженных растений в морской среде намного выше, чем в пресноводной (то есть 3.5 против 1.7). Так два морских погруженных растения зостера и черепаховая трава (Thalassia testudinu), оказались на 50–200% более продуктивными, чем Hydrilla verticillata (Гидрилла мутовчатая) и myriophyllum spicatum (уруть колосистая), два быстрорастущих пресноводных вида [10].
Разница заключается в том, что морским растениям гарантировано достаточное и постоянное поступление углерода из 115 - 143 мг/л бикарбонатов, содержащихся в морской воде [11]. Исследователи [12] предполагают, что морские растения смогли очень хорошо согласовать свои фотосинтетические системы с этим стабильным источником углерода. Таким образом, их фотосинтетические системы обычно работают с максимальной производительностью и эффективностью.
Пресноводные же погруженные растения наоборот, в стоячей пресной воде должны иметь дело с капризными колебаниями уровней CO2 в диапазоне от 0 до более 14 мг/л [13]. В озерах с густой растительностью содержание CO2 может истощаться днем в результате интенсивного фотосинтеза, а затем медленно возвращаться к нормальным уровням ночью.
Экстремальные колебания уровня CO2 в воде могут объяснить, почему водные растения не имеют стабильных C3 и C4 фотосинтетических систем, как у наземных растений - они существуют в континууме фотосинтетических состояний в зависимости от условий произрастания [13]. Похоже, что погруженные в воду пресноводные растения постоянно изо всех сил пытаются адаптировать свои фотосинтетические механизмы к огромным и иногда почасовым колебаниям CO2.
Чтобы выдержать конкуренцию, погруженным растениям пришлось вложиться в дорогостоящее фотосинтетическое оборудование (ферменты) для быстрого улавливания CO2, когда он доступен. Однако, когда уровень CO2 в воде истощается, например, днем во время интенсивного фотосинтеза, это оборудование простаивает. Действительно, типичная скорость фотосинтеза для пресноводных растений составляет всего 38% от максимальной мощности, что намного меньше, чем для морских водорослей и макроводорослей [12]. Растения по-прежнему должны содержать неиспользуемое или простаивающее оборудование; на это расходуется его энергия в виде учащенного дыхания. Результатом является снижение фотосинтетической эффективности и, в конечном итоге, снижение скорости роста пресноводных растений.
Недостаток углерода в природных пресных водах
Пресноводные растения сталкиваются с серьезными проблемами в получении углерода (как CO2, так и бикарбонатов), необходимого им для фотосинтеза. В пресной воде углерода часто бывает мало, и его уровень быстро изменяется. Во время быстрого фотосинтеза водные растения и водоросли часто исчерпывают уровень углерода в воде озера уже к полудню. Фотосинтез часто достигает своего максимума к середине утра и постепенно снижается в течение остальной части дня, даже когда света и других питательных веществ в достаточном количестве [14].
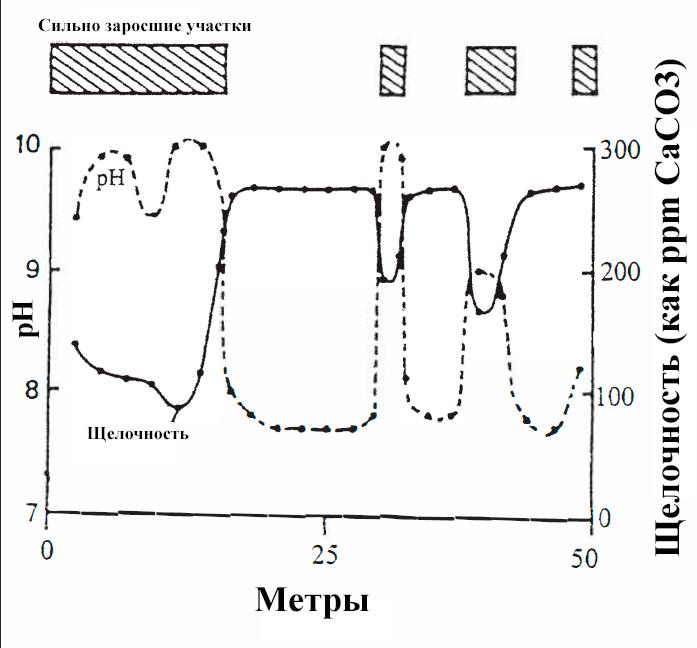
Фотосинтез растений извлекает CO2 непосредственно из воды, что в свою очередь, повышает pH настолько высоко, что весь оставшийся CO2 превращается в бикарбонаты. Бикарбонаты также потребляются, поэтому щелочность снижается. На рис. VI-3 изображен стоячий пруд с с сильно заросшими участками.
рис. VI-3 Изменения pH и щелочности из-за плотных зарослей
 Заштрихованные прямоугольники представляют собой участки плотных зарослей роголистника в пруду. Измерения проводились на 50-метровом разрезе пруда Сангвин летним днем (июнь).
Заштрихованные прямоугольники представляют собой участки плотных зарослей роголистника в пруду. Измерения проводились на 50-метровом разрезе пруда Сангвин летним днем (июнь).Из рисунка видно, что pH намного выше, а щелочность намного ниже на участках с зарослями.
Изменения pH из-за фотосинтеза особенно значительны в слабо щелочной воде, где бикарбонатный буфер меньше. Например, в озере с мягкой водой pH поднялся от кислого уровня в 5.7 утром до 9.6 в полдень (Таблица VI-2). К тому времени выход CO2 снизился с 81% от РНУ до 0,01%.
Таблица VI-2 Дневные колебания в озере c мягкой водой [16].
Star Lake (штат Вермонт) - это озеро с мягкой водой и низкой щелочностью (< 10-20 мг/л CaCO3). Скорость фотосинтеза фитопланктона измерялась в летний день на глубине 0,5 метра с использованием 14C CO2 и HCO3-.
| Время | pH | РНУ (мг/л) | CO2 (% РНУ) | Фотосинтез (мкг/C/l/час) |
|---|---|---|---|---|
| 8:00 | 5.7 | 6.5 | 81 | 5.2 |
| 10:00 | 5.7 | 2.6 | 76 | 16 |
| Полдень | 9.6 | 0.6 | 0.01 | 2.5 |
| 14:00 | 8.3 | 0.9 | 2.0 | 2.9 |
| 16:00 | 6.4 | 2.0 | 54 | 0.4 |
Фотосинтез был самым быстрым в 10:00 утра, когда было много света и CO2. В течение двух часов с 10:00 утра и до полудня фотосинтез резко снизился с 16 мкг/C/l/час до 2,5 мкг/C/l/час. Можно предположить, что в полдень фотосинтез не ограничивался светом и возможно ограничивался не только C02, но и РНУ. К вечеру уровни РНУ и CO2 восстанавливались, но фотосинтез падал до низкого уровня 0,4 мкг/C/l/час.
Wetzel [14] приписывает типичное снижение фотосинтеза во второй половине дня накоплению кислорода. Накопление кислорода в растении и в воде, окружающей растение, вызывает фотодыхание - расточительный процесс, который снижает эффективность фотосинтеза. Снижение, однако, может быть также связано с внутренним циркадным ритмом организма. Например, у Eugiena gracilis не было дневного спада фотосинтеза, когда нормальный циркадный ритм водоросли деактивировался путем манипулирования внеклеточными концентрациями Ca [17].
Стратегии растений по увеличению поглощения углерода
Чем быстрее водные растения усваивают углерод из воды, тем быстрее они растут. Например, исследователи в своей работе [18] пытались найти причину резкого различия в скорости роста 14 разных видов водных растений (время удвоения роста колебалось от 6 до 95 дней). Таким образом, исследователи сравнили скорость роста со скоростью фотосинтеза, концентрацией хлорофилла в листе, биомассой листа, площадью поверхности листа и сродством к углероду. Единственным фактором, который значительно коррелировал с ростом, было сродство к углероду. Получилось, что самое быстрорастущее растение (Sparganium erectum) имело наибольшее сродство к углероду, а самое медленно растущее растение Lobelia dortmanna имело наименьшее сродство к углероду (Таблица VI-3).
Таблица VI-3. Рост растений и поглощение углерода [18].
| Растение | Рост растения (единиц биомассы/сутки) | Сродство с углеродом ("конечный pH" |
|---|---|---|
| Sparganium erectum | 0.109 | 9.6 |
| Batrachium aquatile | 0.097 | 9.5 |
| Potamogeton pectinatus | 0.094 | 9.1 |
| Potamogeton densus | 0.094 | 9.0 |
| Callitriche cophocarpa | 0.088 | 8.8 |
| Elodea canadensis | 0.086 | 9.4 |
| Potamogeton panormitanu.s | 0.067 | 9.3 |
| Potamogeton crispus | 0.052 | 9.3 |
| Myriophyllum spicatum | 0.046 | 8.8 |
| Sparganium emersum | 0.042 | 8.8 |
| Myosotis palustris | 0.030 | 8.9 |
| Berula erecta | 0.020 | 9.0 |
| Littorella uniflora | 0.009 | 8.4 |
| Lobelia dortmanna | 0.007 | 8.2 |
Для определения сродства к углероду отдельные растения помещали в герметичные бутыли, заполненные питательной средой с pH 8,0 и высокой щелочностью (3,8 ммоль бикарбонатов). После 24 часов непрерывного освещения и перемешивания воды был измерен pH. Более сильное повышение pH всегда коррелирует с большим сродством к углероду (удаление CO2 и бикарбоната из воды). Рост растений измеряли в отдельном 4 - 6 недельном эксперименте.
Поскольку получение углерода часто является проблемой для водных растений, многие водные растения разработали гениальные стратегии для увеличения его поглощения. Существует пять известных стратегий [13,20]: (1) хранение CO2 в виде малата; (2) удержание вдыхаемого CO2; (3) поглощение бикарбоната; (4) поглощение CO2 из грунта корнями; и (5) воздушное питание.
1. Хранение CO2 в виде малата
Вместо того, чтобы поглощать C02 только днем во время фотосинтеза, некоторые водные растения научились поглощать C02 всегда, когда он доступен, особенно ночью. Растения превращают ночной CO2 в углеводный малат, а затем в течение дня расходуют его для выработки CO2 в целях фотосинтеза. Это позволяет растениям осуществлять фотосинтез в окружающей среде, в которой в течение дня может образовываться дефицит CO2.
Эта стратегия не так распространена для водных растений, как для наземных. Ее использует жизнестойкая Hydrilla verticillata (Гидрилла мутовчатая) в летний период, а также растения изоэтидного типа.
Кислотный метаболизм толстянковых (CAM) используется многими пустынными растениями для накопления СО2 в ночное время. Благодаря этому, они могут держать свои устьица закрытыми днем, чтобы минимизировать потерю воды.
2. Удержание вдыхаемого CO2
Когда уровень CO2 в воде постоянно низкий, некоторые виды растений, в основном растения изоэтидного типа, могут повторно использовать CO2, образующийся при их собственном дыхании. Растение удерживает выдыхаемый ими CO2 в своих больших внутренних газовых камерах (лакунах). У нескольких изученных видов от 30 до 40% этого внутреннего CO2 повторно используется в процессе фотосинтеза [20].
3. Поглощение бикарбоната
CO2 всегда не хватает, зато в щелочной воде полно бикарбонатов. Таким образом, растения, растущие в щелочной воде и умеющие использовать бикарбонаты (в дополнение к CO2), получают огромное преимущество. Около половины протестированных водных растений могут использовать бикарбонаты [12]. В таблице VI-4 перечислены некоторые виды растений, которые могут и не могут использовать бикарбонаты.
| Растения, использующие бикарбонаты | Растения, не использующие бикарбонаты |
|---|---|
| Ceratophyllum demersum [23] (Роголистник погруженный) | Callitriche cophocarpa [24] (Болотник короткоплодный) |
| Chara [12] | Ceratopteris sp. [23] |
| Egeria densa [23] | Echinodorus paniculatus [23] (Эхинодорус метельчатый) |
| Elodea canadensis [23] (Элодея канадская) | Echinodorus tenellus [23] (Эхинодорус нежный) |
| Hydrilla verticillata [23] (Гидрилла мутовчатая) | Isoetes sp. [10] |
| Myriophyllum spicatum [23] (Уруть колосистая) | Ludwigia natans [23] (Людвигия ползучая) |
| Potamogeton crispus [24] (Рдест курчавый) | Myriophyllum brasiliense [23] (Перистолистник бразильский) |
| Potamogeton lucens [23] (Рдест блестящий) | Myriophyllum hippuroides [23] (Перистолистник хвостиковидный) |
| Potamogeton pectinatus [24] (Рдест гребенчатый) | Myriophyllum verticillatum [23] (Перистолистник мутовчатый) |
| Potamogeton perfoliatus [23] (Рдест пронзеннолистный) | Nuphar lutea [23] (Кубышка жёлтая) |
| Stratiotes aloides [23] (Телорез алоэвидный) | Ricca fluitans [23] (Риччия плавающая) |
| Vallisneria spiralis [23] (Валлиснерия спиральная) | Sparganium simplex [24] (Ежеголовник всплывающий) |
| Sphagnum cuspidatum [22] |
Обычно такие растения, как Myriophyllum spicatum, которые могут использовать бикарбонат, растут в природе в щелочной воде. Однако некоторые водные растения (Callitriche stagnalis и Sparganium simplex), несмотря на то, что не могут использовать бикарбонаты, по-видимому, извлекают достаточно CO2 из протекающих щелочных потоков жесткой воды, чтобы эффективно конкурировать с потребителями бикарбонатов [24].
Водные растения проявляют некоторую гибкость в том, могут или не могут они использовать бикарбонаты. Так, Callitriche cophocarpa может использовать бикарбонаты, но только при достаточно высокой их концентрации [21]. Растения, которые, по-видимому, вообще не могут использовать бикарбонаты - это мохообразные (например, водные мхи и печеночники) [10]. Обычно эти растения происходят из мягких кислых вод, где C02 достаточно.
Поскольку многие амфибии не особо хорошо умеют использовать бикарбонаты, было высказано предположение, что они, возможно, «выбрали» в ходе эволюции стратегию выхода на воздух (а не поглощение бикарбоната) для увеличения накопления углерода [13,25]. (Тем не менее, есть по крайней мере одно исключение - рдест амфибия Potamogeton gramineus, которая может довольно эффективно использовать бикарбонаты [26]).
Растения предпочитают CO2 бикарбонатам в соотношении 10 к 1 [27], вероятно, потому что поглощение бикарбоната требует усилий. Как видим, даже самое жестководное растение Potamogeton pectinatus использует бикарбонаты с гораздо меньшей эффективностью, чем CO2 [24]. А Elodea canadensis в среде с высоким содержанием бикарбоната росла вдвое быстрее, когда в среду вносили CO2 [28]. В целом пресноводные водные растения используют бикарбонаты гораздо менее эффективно, чем многие водоросли.
Некоторые пользователи бикарбоната поляризуют свои листья во время его поглощения. Поляризация в поглощении бикарбоната была описана для Potamogeton lucens [26]. Растение выделяет на нижней стороне листьев H+ (кислоту) , обеспечивая pH около 6. Эта кислотность превращает бикарбонат в CO2, который диффундирует в лист и используется для фотосинтеза. Для поддержания растением своего внутреннего баланса заряда, оно поглощает H+ на верхней поверхности листа, что приводит к высокому локализованному pH (около 10) и высокой концентрации гидроксида (OH-).
OH- соединяется с бикарбонатом кальция [Ca(HC03)2], вызывая осаждение карбоната кальция (CaC03) на верхней части листа. В жесткой щелочной воде эта реакция, называемая «биогенной декальцинацией», бывает настолько сильной, что корка осажденного CaCO3 может весить больше, чем находящееся под ней растение [29]. Я видела, как CaC03 откладывался в виде небольших белых пупырышков на листьях Egeria densa и Ludwigia repens, растущих в жесткой воде при интенсивном освещении.
Некоторые водные растения (например, Myriophyllum spicatum и Vallisneria spiralis), использующие бикарбонаты, не поляризуют свои листья для их поглощения [23]
4. Поглощение CO2 корнями из грунта
Вода в грунте обычно содержит намного более высокие концентрации CO2, чем поверхностная - часто в 50 - 100 раз больше. Логично предположить, что многие растения будут извлекать CO2 из грунта и использовать его для фотосинтеза. Однако, похоже, что это не так.
По причине медленных скоростей диффузии CO2 как в воде грунта, так и внутри растений, использование грунтового CO2 для растений намного труднее, чем поглощение его листьями [12].
Таким образом, использование грунтового CO2 обычно ограничивается растениями изоэтидного типа - Isoetes (Полушник), Eriocaulon, Littorella uniflora, Lobelia dortmanna и в меньшей степени Juncus bulbosus (Ситник луковичный) [30]. Эти медленнорастущие вечнозеленые виды распространены в озерах с мягкой водой, в которых очень мало CO2 и других питательных веществ. Обычно растения растут в виде розеток с короткими толстыми листьями, содержащими обширные продольные лакунарные каналы. (Эти каналы ускоряют перемещение СО2 от корней к листьям.)
Растения бывают настолько приспособлены к поглощению грунтового CO2, что могут даже предпочитать этот способ обычному листовому поглощению. Так, когда Juncus bulbosus выращивали в разделенных камерах, то если корни удобряли CO2, поглощение его листьями немедленно и существенно снижалось [31].
5. Воздушное питание
Водные растения-амфибии выпускают воздушные листья, чтобы получить прямой доступ к углекислому газу воздуха. Как правило, воздушные листья образуются летом, реагируя на изменения светового спектра [13]. Стратегия надводных листьев дает водным растениям существенные преимущества.
6. Другие стратегии
В природе Hydrilla verticillata часто доминирует над другими водными растениями. Этот вид может осуществлять фотосинтез при слабом освещении, что дает ему сильное конкурентное преимущество в получении CO2 по сравнению с видами, которым требуется больше света.
Для Hydrilla verticillata, Ceratophyllum demersum, Myriophyllum spicatum и Cabomba caroliniana световыми точками компенсации являются 15, 35, 35 и 55 мкмоль/м2/сек соответственно [33]. Таким образом, ранним утром, когда света еще мало, а CO2 еще много, Hydrilla начинает фотосинтез. К середине утра, когда света становится достаточно для других видов, Hydrilla может уже выбрать изрядное количество углекислого газа. Свет у конкурентов есть, а CO2 нет.
 Hydrilla verticillata, сильный конкурент.
Hydrilla verticillata, сильный конкурент.
lsoetes lacustris (Полушник озёрный). I. lacustris, который родом из водоемов с кислой и мягкой водой, сильно обедненных CO2, разработал по крайней мере три гениальных стратегии ( хранение CO2 в виде малата, удержание вдыхаемого CO2 и поглощение CO2 корнями из грунта) для получения драгоценного неорганического углерода. Этот вид олицетворяет «изоэтидный образ жизни», которому привержены также несколько других родов [32]. Эти неродственные виды часто встречаются вместе, имеют схожую морфологию растений, тип среды обитания и физиологию.
Доступные растениям источники углерода
Озера и реки почти всегда содержат больше CO2, чем можно было бы ожидать от простого равновесия с воздухом [9]. Дополнительный углекислый газ выделяется в процессах разложения органики. Его уровень может быть значительным, так как природные воды содержат много растворенного органического углерода (РОУ). Большая часть этого РОУ находится в процессе разложения и, следовательно, является потенциальным источником CO2.
Многие водные растения не смогли бы выжить в природе без CO2, образующегося при разложении. Концентрация углекислого газа в воде, равновесного воздуху 0,5 мг/л, а многим водным растениям требуется гораздо большая концентрация. К примеру, при концентрации CO2 менее 36 мг/л, мох Sphagnum cuspidatum оказывался либо погибшим, либо погибающим. И было обнаружено, что Callitriche cophocarpa (Болотник короткоплодный) и Ranunculus peltatus (Шелковник щитовидный), живущие в ручьях с концентрацией углекислого газа, равной 5 mg/I, также испытывали дефицит CO2. Поскольку эти виды не могут использовать бикарбонаты, они зависят от CO2, выделяемого при разложении.
CO2 в аквариуме
В конечном итоге CO2 появляется в аквариуме из рыбьего корма и органики почвы (см. Табл V-5). Для превращения органических веществ в углекислый газ оба этих источника требуют либо гниения, либо обмена веществ рыб. Если не используется дополнительная продувка CO2, то важно избежать потерь углекислого газа, а теряется он в результате действий, направленных на увеличение соприкосновения воды с воздухом - аэрация, течение и влажно-сухие фильтры.
Аквариумисту следует настроить течение воды, которое увеличивает возможности растений в поглощении питательных веществ, распределяет тепло и доставляет рыбам кислород таким образом, чтобы не улетучился весь CO2. Я стараюсь поддерживать движение воды ровно настолько, чтобы обеспечить рыбу кислородом.
Вся органика в аквариуме, по сути, является запасом потенциального CO2. Примерами органических веществ являются ил и растворенный в воде органический углерод (РОУ).
Чистка аквариума (подмена воды, угольная фильтрация, сифонивание грунта, очистка фильтров) удаляют органические вещества и их потенциал для обеспечения растений CO2. Поэтому я не чищу аквариумы и фильтры без особой необходимости.
Водным растениям в их естественной среде обитания пришлось адаптироваться к низким и постоянно меняющимся уровням CO2. Многие растения разработали гениальные стратегии для увеличения поглощения углерода или сохранения того, что у них есть. И сам факт того, что существует так много стратегий, предполагает, что погруженные пресноводные растения часто испытывают проблемы с получением достаточного количества углерода.
Все те трудности получения CO2, с которыми сталкиваются погруженные водные растения в природе, переносятся и в аквариум. Хотя любители могут значительно улучшить рост растений с помощью искусственных средств (продувание CO2), я бы посоветовала им попробовать более естественные средства (позволить процессам разложения выделять CO2).
В. Что вы думаете о системах принудительной подачи CO2 в аквариум? Считаете ли вы, что овчинка стоит выделки?
О. Стоят ли системы подачи CO2 своих денег - вопрос, который каждый сам решает для себя. Я их не использую, потому что меня устраивают мои растения и аквариумы. Как правило, с дополнительным CO2 аквариумные растения будут расти намного лучше. Это связано с тем, что CO2 часто является ограничивающим питательным веществом в большинстве аквариумов, включая мой собственный, в то время как других питательных веществ, таких как азот и фосфор всегда хватает.
Недостатком является то, что аквариумы с принудительной подачей CO2 требуют на много больше вложений труда. Не всем любителям нравится частая обрезка и прополка. К тому же, когда CO2 больше не является ограничивающим фактором, истощаются другие питательные вещества, что требует дополнительного внесения удобрений. Еще нужно постоянно мониторить уровни pH и KH на предмет не истощился ли щелочной буфер. А если у вас мягкая вода, то нужно будет регулярно добавлять бикарбонат натрия или карбонат кальция, чтобы поддерживать KH, безопасный для рыб. И все равно время от времени аквариумисты сообщают о массовой гибели рыб ночью из-за передозировки углекислого газа.
Кроме того, внесение CO2 может оказывать долгосрочное воздействие на субстрат.
В экспериментальных наземных экосистемах внесение дополнительного CO2 не только усилило фотосинтез, но и увеличило высвобождение РОУ корнями. В частности, исследователи отметили двукратное увеличение РОУ в верхних 15 см почвы, а также значительные изменения в грибковом сообществе почвы после повышения уровня CO2 в воздухе на 50% для трех поколений растений [34].
Так, некоторые аквариумисты описывают чудесный рост растений благодаря своим новым системам подачи CO2 только для того, чтобы через год или два объявить о необъяснимом коллапсе их аквариумов.
Литература
1. Wetzel RG. 1983. Limnology (Second Ed.). Saunders College Publishing (Philadelphia, PA), p. 207.
2. Boyd, CE. 1995. Bottom Soils, Sediment, and Pond Aquaculture. Chapman & Hall (NY), p. 262.
3. Wetzel 1983, p. 204.
4. King DL. 1972. Carbon limitation in sewage lagoons. In: Liken GE (ed.), Nutrients and Eutrophication:
The Limiting Nutrient Controversy. Special Symposium, Am. Soc. Limnol. Oceanogr. 1: 98-110.
5. Weber JA, Tenhunen JD, Yocum CS, and Gates DM. 1979. Variation of photosynthesis in Elodea
densa with pH and/or high CO2 concentrations. Photosynthetica 13: 454-458.
6. Pokorny J, Ondok JP and Koncalova H. 1985. Photosynthetic response to inorganic carbon in Elodea
densa (Planchon) Caspary. Photosynthetica 19: 366-372.
7. Wetzel 1983, p. 547.
8. Cole JJ, Caraco NF, Kling GW, and Kratz TK. 1994. Carbon dioxide supersaturation in the surface
waters oflakes. Science 265: 1568-1570.
9. Titus JE, Feldman RS, and Grise D. 1990. Submersed macrophyte gro-wth at low pH. 1. C 02 enrichment
effects with fertile sediment. Oecologia 84: 3 07-313.
10. Boston HL, Adams MS, and Madsen JD. 1989. Photosynthetic strategies and productivity in aquatic
systems. Aquat. Bot. 34: 27-57.
11. Reis.kind JB, Seamon PT, and Bowes G. 1989. Photosynthetic responses and anatomical features of
two marine macroalgae with different CO2 compensation points. Aquat. Bot. 33: 71-86.
12. Madsen TV and Sand-Jensen K. 1991. Photosynthetic carbon assimilation in aquatic macrophytes.
Aquat. Bot. 4 l: 5-40.
13. Bowes G. 1987. Aquatic plant photosynthesis: Strategies that enhance carbon gain. In: Crawford
RMM (ed), Plant Life in Aquatic and Amphibious Habitats. Blackwell Scientific Publications (Boston, MA), pp. 79-98.
14. Wetzel 1983, p. 533.
102
15. Wetzel 1983, p. 555.
16. Allen HL. 1972. Phytoplankton photosynthesis, micronutrient interactions, and inorganic carbon
availability in a soft-water Vennont lake. In: Likens GE (Ed.), Nutrients and Eutrophication: The
Limiting Nutrient Controversy. Special Symposium, Amer. Soc. Limnol. Oceanogr. 1:63-83.
17. Lonergan TA 1990. Steps linking the photosynthetic light reactions to the biological clock require
calcium. Plant Physiol. 93: 110-115.
18. Nielsen SL and Sand-Jensen K. 1991. Variation in growth rates of submerged rooted macrophytes.
Aquat. Bot. 39: 109-120.
19. Aquatic plant line drawings are the copyright property of the University of Florida Center for Aquatic
Plants (Gainesville).
20. Wetzel RG. 1990. Land-water interfaces: Metabolic and limnological regulators. Verh. Int. Ver.
Limnol. 24: 6-24.
21. Madsen TV and Maberly SC. 1991. Diurnal variation in light and carbon limitation of photosynthesis
by two speecies of submerged freshwater macrophyte with a differential ability to use bicarbonate.
Freshwater Biol. 26: 175-187.
22. Paffen BGP and Roelofs JGM. 1991. Impact of CO2 and ammonium on the growth of submerged
Sphagnum cuspidatum. Aquat. Bot. 40: 61-71.
23. Prins HBA, O'Brien J and Zanstra PE. 1982. Bicarbonate utilization in aquatic angiospenns. pH and
CO2 concentrations at the leaf surface. In: Symoens JJ, Hooper SS, and Compere P. Studies on
Aquatic Vascular Plants. Royal Botanical Society of Belgium (Brussels Belgium), pp. 112-119.
24. Sand-Jensen K. 1983. Photosynthetic carbon sources of stream macrophytes. J. Exp. Bot. 34: 198-210.
25. Bristow JM. 1969. The effects of carbon dioxide on the growth and development of amphibious
plants. Can. J. Bot. 47: 1803-1807.
26. Frost-Christensen Hand Sand-Jensen K. 1995. Comparative kinetics of photosynthesis in floating and
submergedPotam?geton leaves. Aquat. Bot. 51: 121-134.
27. Wetzel 1983, p. 219.
28. Smith CS. 1993. A bicarbonate-containing medium for the solution culture of submersed plants.
Can. J. Bot. 71: 1584-1588.
29. Wetzel 1983, p. 206.
30. Raven JA, Handley LL, Macfarlane JJ, Mclnroy S, McKenzie L, Richard lli, and Samuelsson G.
1988. Toe role of CO2 uptake by roots and CAM in acquisition of inorganic C by plants of the isoetid
lifeform: A review, with new data on Eriocaulon decangulare L. New Phytol. 108: 125-148.
31. Wetzel RG, Brammer ES, Lindstrom K, and Forsberg C. 1985. Photosynthesis of submersed macrophytes
in acidified lakes. II. Carbon limitation and utilization ofbenthic CO2 sources. Aquat. Bot. 22:
107-120.
32. Preston CD and Croft JM. 1997. Aquatic Plants in Britain and Ireland. B.H. & A. Harley Ltd (Essex,
England).
3 3. Van TK, Haller WT, and Bowes G. 197 6. Comparison of the photosynthetic characteristics of three
submersed aquatic plants. Plant Physiol. 58: 761-768.
34. Jones TH, Thompson LJ, Lawton lli, Bezemer TM, Bardgett RD, Blackburn TM, Bruce KD, Cannon
PF, Hall GS, Hartley SE, Howson G, Jones CG, Kampichler C, Kandeler E and Ritchie DA. 1998.
Impacts of rising atmospheric carbon dioxide on model terrestrial ecosystems. Science 280: 441-443.




***
Комментарии: