Диана Вальштад. Питание и экология растений
Diana L. Walstad "Ecology Of The Planted Aquarium"
Необходимые питательные вещества
Поскольку растения сами производят себе пищу, их потребности в питательных веществах просты - им требуется всего 17 химических элементов:
Таблица VII-1
| Химический элемент | Питательная форма | Основная функция в организмах растений |
|---|---|---|
| B (бор) | BO33- | Функция клеточных мембран, нормальный рост корней и цветение" |
| C (углерод) | CO2, HCO3- | Строительный материал всех органических соединений |
| Ca (кальций) | Ca2+ | Активатор ферментов, внутриклеточный «вторичный мессенджер» - необходим для проницаемости клеточной мембраны и структуры клеточной стенки |
| Cl (хлор) | Cl- | Осмос, балансировка заряда, фотолиз воды |
| Cu (медь) | Cu2+ | Компонент ферментов для переноса электронов и других окислительно-восстановительных реакций |
| Fe (железо) | Fe2+, Fe3+ |
Компонент ферментов для переноса электронов и других окислительно-восстановительных реакций |
| H (водород) | H2O | Строительный материал всех органических соединений |
| K (калий) | K+ | Активатор ферментов, балансировка заряда |
| Mg (магний) | Mg2+ | Активатор ферментов и ключевой компонент хлорофилла |
| Mn (марганец) | Mn2+ | Активатор ферментов, необходимых для фотолиза H2O |
| Mo (молибден) | MoO42- | Компонент нитратредуктазы, фермента, необходимого для химического восстановления нитратов. |
| N (азот) | NH3, NH4+, NO2-, NO3- |
Компонент белков, нуклеиновых кислот и др. |
| Ni (никель) | Ni2+ | Важный компонент фермента уреазы |
| O (кислород) | CO2, H2O | Строительный материал всех органических соединений |
| P (фосфор) | PO4- | Компонент АТФ, НАДФ, нуклеиновых кислот, фосфолипидов мембран |
| S (сера) | SO42- | Компонент белков |
| Zn | Zn2+ | Компонент 60-ти ферментов |
Конкурентное потребление питательных веществ
Питательные вещества конкурируют между собой за поглощение растениями, так что из-за большого избытка одного питательного вещества может уменьшиться поглощение другого. Например, чрезмерная концентрация Mn, Zn и Cu может вызывать у растений дефицит железа [3]. И наоборот, при избытке железа у гидриллы (Hydrilla) наблюдалось снижение уровня марганца. Если добавлялся аммоний (NH4+) к культурам ряски, то при определенных обстоятельствах ряска выделяла в воду калий K+[5]. Кальций конкурирует с тяжелыми металлами за поглощение клетками, поэтому жесткость воды может влиять как на токсичность металлов, так и на доступность питательных микроэлементов.
Накапливание питательных веществ и критическая концентрация
Для нормального роста растениям требуется минимальный уровень каждого питательного вещества в тканях растения. Критическая концентрация - это минимальная концентрация питательного элемента в тканях растения, не ограничивающая его рост. Если растение содержит питательного вещества больше, чем критическая концентрация, это означает, что растение получает достаточное его количество и накапливает избыток; если растение содержит концентрацию ниже критической, значит, растение не получает достаточного количества этого питательного вещества.
Хотя между видами растений есть некоторые различия в значениях критических концентраций, значения, которые Герлофф [6] сообщил для Elodea occidentalis, часто используются аква-ботаниками для измерения дефицита питательных веществ. Используя значения критической концентрации для Eiodea, можно сделать предварительные утверждения о доступности питательных веществ в окружающей среде растения.
Если в окружающей среде содержится изобилие определенного питательного вещества, растения потребляют его в большем количестве, чем критическая концентрация. Более того, растения будут поглощать токсичные элементы, такие как свинец и кадмий, в которых они и не нуждаются вовсе. Химический анализ моих аквариумных растений (Таблица VII-2) показывает, что они явно получают изрядное количество всех перечисленных питательных веществ. Например, цинка они накопили 104 критические концентрации (по 8 мг/кг). Поскольку все перечисленные питательные вещества были обнаружены в моих растениях в избытке, рост растений, вероятно, ограничивался углеродом - гипотеза, подтверждаемая моим более ранним анализом рыбьего корма, воды и почвы.
Умеренное движение воды - лучший выбор
Движение воды часто бывает полезным, потому что оно быстрее и ближе к листьям доставляет CO2 и другие питательные вещества . Однако из-за слишком сильного течения, которое может оказывать жесткое механическое воздействие на растения и на испарение CO2, фотосинтез и рост растений могут замедлиться. Например, течение воды со скоростью около 1 см/сек стимулировало фотосинтез у Callitriche stagnalis (Болотник прудовой), но более быстрое течение (4 см/сек) уменьшало фотосинтез на 13-29% [7]. А в другом исследовании Ranuncuius aquatilis (Водный лютик) показал максимальный рост при умеренной скорости потока 11 см/сек; рост уменьшался при более низкой скорости (<2 см/сек) и при более высокой скорости (23 см/сек) [8].
Грунтовое поглощение питательных веществ против водного
Большинство растений в природе растут в относительно чистой воде. В таких условиях питательные вещества больше сконцентрированы в грунте, чем в воде и поэтому грунтовые отложения становятся основным источником питательных веществ для укореняющихся растений. Особенно это касается фосфора, железа и других микроэлементов [9]. Напротив, питательные вещества, которые связаны с жесткостью - калий, кальций, магний, хлориды и сульфаты («питательные вещества жесткой воды») - обычно поступают из воды.
Однако «старая» аквариумная вода содержит гораздо более высокие концентрации питательных веществ, чем большинство природных вод.
Озера, содержащие более 1.5 ppm азота и 0.1 ppm фосфора, являются загрязненными и классифицируются как «гиперэвтрофные» [10]. Мои акванумы содержат такие же или более высокие концентрации N и P.
Можно ожидать, что в аквариумах вода станет основным источником питательных веществ.
Таблица VII-2. Накопление питательных веществ моими аквариумными растениями.
| Химический элемент | Критическая концентрация (мг/кг) |
Хим. элементы, найденные в моем аквариуме (мг/кг) |
|---|---|---|
| B | 1.3 | 27 |
| Ca | 2800 | 9100 |
| Cu | 0.8 | 21 |
| Fe | 60 | 200 |
| K | 8000 | 45000 |
| Mg | 1000 | 6600 |
| Mn | 4 | 350 |
| Mo | 0.15 | 0.6 |
| N | 16000 | 39000 |
| P | 1400 | 5600 |
| S | 800 | 4900 |
| Zn | 8 | 834 |
Критические концентрации по каждому хим. элементу публиковались для Elodea occidentalis [6]. Элементы, обнаруженные в моих растениях, взяты из химического анализа, проведенного агрономической лабораторией штата Северная Каролина. Цифры представляют собой среднее значение трех отдельных анализов здоровых стеблей/листьев растений из трех моих аквариумов.
Перемещение питательных веществ
Перемещение питательных веществ позволяет водным растениям прочесывать воду или субстрат в поисках питательных веществ. Используя радиоизотопные индикаторы, ученые могут отслеживать движение питательного вещества внутри растения.
Например, Myriophyllum exalbescens распределяет фосфор, поглощенный корнями, по стеблям и листьям в течение 8 часов. Точно так же фосфор, поглощенный стеблем и листьями растения, частично перемещался в корни. По всей видимости, внутри растения имеется проточная система с давлением внутри нее, поскольку часть фосфора, поглощаемого корнями M. exalbescens, высвобождается в воду листьями и стеблем [11].
В погруженных растениях перемещение питательных веществ может происходить из-за осмотического давления, создаваемого в корнях.
Для некоторого перемещения, однако, явно требуется энергия, потому что, когда корни Sparganium emersum обрабатывали метаболическими ингибиторами, перемещение значительно замедлялось. Например, снижение температуры корня с 15 до 10 ° C уменьшило перемещение (временно) примерно в 5 раз [12]. Также у Myriophyllum еxalbescens перемещение кальция происходило только на свету; Са не переносился в темноте [11], из чего можно предположить, что для перемещения Са требуется энергия, в данном случае энергия фотосинтеза.
(У воды в грунте более высокое осмотическое давление, чем у воды над ним). И действительно, один исследователь, используя помеченную радиацией воду, установил наличие водной транспортной системы у двух растений (Lobelia dortmanna и Sparganium emersum) [12]. Вода из корней проходила через ксилему и выходила в воду из кончиков листьев. И хотя скорость потока не такая высокая, как у наземных растений, благодаря их транспирации, но судя по всему достаточная для обеспечения всего растения питательными веществами, найденными в грунте.
Растения предпочитают поглощение фосфора корнями
Многие водные растения предпочитают поглощать фосфор (P) корнями. Например, исследователи [13] установили, что 3 вида водных растений при наличии выбора потребляли больше фосфора из субстрата, чем из воды. Чтобы убедиться в этом, исследователи использовали радиоактивный P (32P-фосфат) и выращивали растения в «раздельных камерах», где листья/стебли растений были подвешены в верхней камере, изолированной от нижней камеры, в которой содержались корни растения. (Две камеры содержали полноценные питательные среды с 32P-фосфатом или без него.) Исследователи обнаружили, что большая часть фосфора в новых побегах не абсорбируется из верхней камеры с листьями и стеблем, а поступает из корней в нижнем отделении. Особенно это касалось Myriophyllum brasiliense. Этот вид поглощал корнями более 90% фосфора, а M. spicatum и Elodea densa поглощали корнями соответственно 59% и 74% фосфора. В других экспериментах исследователями также было установлено, что поглощение фосфора корнями происходит быстрее, чем поглощение стеблем и листьями.
Было установлено, что другие растения (Myriophyllum altemiflorum, Potamogeton zosteriformis, Potamogeton foliosus, Callitriche hermaphroditica, Elodea canadensis и Najas flexilis) предпочитают поглощение фосфора корнями [15]; они получили весь свой фосфор из грунта, когда его уровень в воде был менее 0.03 ppm. Более позднее исследование показало, что Najas flexilis поглощает из грунта более 99% фосфора [16].
Растения предпочитают поглощение калия листьями и стеблем
По видимому, водные растения гораздо охотнее поглощают калий из воды. Так, Elodea occidentalis поглощала калий стеблем и листьями более чем в 5 раз быстрее, чем корнями [6]. А Potamogeton pectinatus демонстрировал замедленные рост и цветение, когда калий отсутствовал в воде, даже несмотря на то, что в грунте содержание калия было в достаточном количестве.
В действительности, поглощение K листьями настолько преобладает над поглощением корнями, что некоторые водные растения фактически выделяют калий в грунт, а не поглощают его оттуда[18]. Например, поглощая N и P из питательного субстрата, Hydrilla фактически увеличила и без того высокие уровни K в том же субстрате на 61% после 12 недель роста [19]. Такое же обогащение грунта калием было обнаружено и у Myriophyllum spicatum [20].
Исследователи [18] предположили, что в условиях ограничения азота водные растения могут перекачивать калий из воды в грунт для извлечения аммония. Два питательных вещества K+ и аммоний (NH4+) конкурируют за участки связывания на частицах почвы. Таким образом, если корни растения увеличивают концентрацию K+ в почве, то NH4+ будет высвобождаться из участков связывания и растворяться в почвенной воде, откуда корни могут его впитывать.
Водные растения предпочитают поглощение аммония листьями
Хотя потребности водных растений в азоте могут быть обеспечены единственно только аммонием из донных отложений, вода, по-видимому, является предпочтительным его источником [21, 22]. Например, в эксперименте с разделенной камерой с Zostera marina [23], когда аммоний был добавлен в камеру с листьями и стеблем, поглощение корнями было снижено на 77%. Когда аммоний был добавлен в корневую камеру, поглощение листьями, однако, не уменьшилось.
Работа с другими видами растений подтверждает вышесказанное. По-видимому, водоросли Amphibolis antarctica могут поглощать аммоний листьями от 5 до 38 раз быстрее, чем корнями [24]. А Myriophyllum spicatum, посаженный в питательный грунт, прекрасно рос без аммония в воде. Если же в воду добавляли аммоний (0,1 мг/л N), растения поглощали больше азота из воды, чем из грунта [25].
Азотное питание водных растений
Водные растения предпочитают аммоний нитратам
В качестве источника азота водные растения могут использовать аммоний (NH4+), нитриты (NO2-) или нитраты (NO3-). Обнаружилось, что многие водные растения предпочитают аммоний нитратам, и степень этого предпочтения значительна. Например, Elodea nuttallii, растущая в смеси аммония и нитратов, удалила из раствора 50% исходного аммония через 8 часов, но нитратов удалила мало (рис. VII-1). Только когда большая часть аммония была израсходована (то есть примерно через 16 часов), началось поглощение нитратов.
Рисунок vll-1. Поглощение аммония и нитратов Elodea nuttallii.
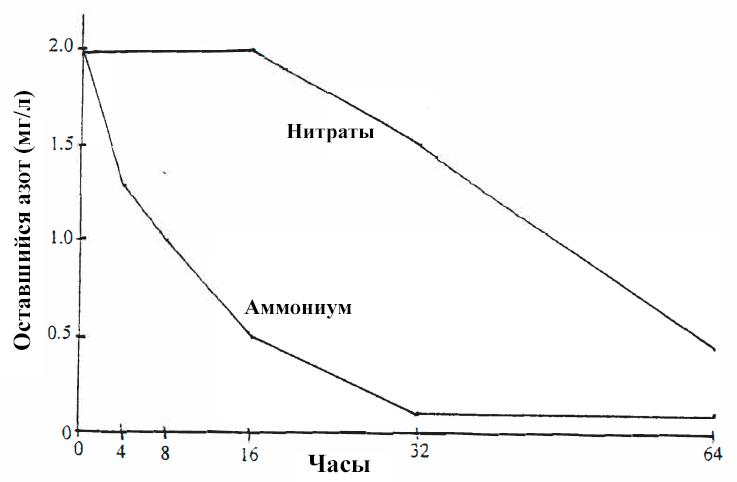 Растения (0.5 г сухого веса) помещали в 1 литр отфильтрованной озерной воды, содержащей по 2 мг/л азота в пересчете на NO3 и NH4. Концентрации аммония и нитратов измеряли через 4, 8, 16, 32 и 64 часа. Для каждого периода воздействия использовали 3 резервуара с растениями и 3 контрольных резервуара без растений. Контрольные аквариумы показали небольшие потери азота (NO3 и NH4) за счет деятельности бактерий.
Растения (0.5 г сухого веса) помещали в 1 литр отфильтрованной озерной воды, содержащей по 2 мг/л азота в пересчете на NO3 и NH4. Концентрации аммония и нитратов измеряли через 4, 8, 16, 32 и 64 часа. Для каждого периода воздействия использовали 3 резервуара с растениями и 3 контрольных резервуара без растений. Контрольные аквариумы показали небольшие потери азота (NO3 и NH4) за счет деятельности бактерий.Водные растения усваивают аммоний быстрее, чем нитраты. Например, выяснилось, что «время оборота» аммония (при 0.4 ppm N) у Pistia stratiotes составило всего 4 часа, в то время как для оборота нитратов потребовалось полных 20 часов [39].
Аммоний часто подавляет поглощение и ассимиляцию нитратов у различных организмов [44]. Например, водоросли не поглощают нитраты, если концентрация аммония превышает 1 мкМ (0,018 мг/л) [46]. Быстрое прекращение поглощения нитратов при добавлении аммония в питательные растворы широко исследовалось на ряске (5, 35, 36). Ингибирование обычно обратимо, так как растения будут поглощать нитраты через день или два после того, как весь аммоний будет израсходован.
Случающееся немедленное ингибирование (в пределах 1 мин) может быть связано с деполяризацией мембраны и ингибированием выделения H+ под действием NH4+. (Для проникновения в клетку NO3- необходимо одновременное выделение H+ из клетки). Более позднее ингибирование (примерно через час) может быть связано с подавлением нитратредуктазы.
Оказалось, что из 33 исследованных видов водных растений , большинство предпочитают аммоний нитратам (Таблица VII-3).
C. demersum потреблял больше нитратов днем, но ночью - исключительно аммоний. (Для поглощения нитратов требуется свет.)
| Растения, предпочитающие аммоний | Растения, предпочитающие нитраты |
|---|---|
| Agrostis canina [22] | Echinodorus ranunculoides [22] |
| Callitriche hamulata [26) | Littorella unijlora [22] |
| Ceratophyllum demersum [27] | Lobelia dortmanna [22] |
| Drepanocladus jluitans [22] | Luronium natans f22l |
| Eichhomia crassipes [28) | |
| Elodea densa [29] | |
| Elodea nuttallii [30] | |
| Fontinalis antipyretica [31] | |
| Hydrocotyle umbellata [32] | |
| Juncus bulbosus [22,33] | |
| Jungermannia vulcanicola [34] | |
| Lemna gibba [35,36,37] | |
| Lemna minor [5] | |
| Marchantia polymorpha (38] | |
| Myriophyllum spicatum [25] | |
| Pistia stratiotes [39] | |
| Ranunculus fluitans [26] | |
| Salvinia molesta [40] | |
| Scapania undulata [34] | |
| Sphagnum cuspidatum [41] | |
| Sphagnumfallax [41] | |
| Sphagnum jlexuosum [22] | |
| Sphagnumfuscum [41] | |
| Sphagnum magellanicum [41] | |
| Sphagnum papillosum [ 41] | |
| Sphagnum pulchrum [ 41] | |
| Sphagnum rubellum [41] | |
| Spirodela oligorrhiza [42] | |
| Zostera marina [21,43] |
То, что наземные растения лучше растут на нитратах и то, что некоторые ботаники успешно выращивают растения на нитратах, не должно умалять тот факт, что водные растения - при наличии выбора - в большей степени предпочитают аммоний. Лучше ли они растут с аммонием - это отдельный вопрос, не критичный для здоровья рыб или функционирования аквариума. Тем не менее, я бы предположила, что большинство водных растений все-таки лучше растут с аммонием.
Источник азота для лучшего роста
Исследований, сравнивающих влияние нитратов и аммония на рост водных растений, меньше, чем исследований по предпочтению их поглощения, обсуждавшегося параграфом выше. Тот факт, что из смеси аммония и нитратов растения поглощают преимущественно аммоний, не гарантирует, того что на аммонии они будут лучше расти.
Кроме того, исследования, которые показывают плохой рост растений с аммонием, могут быть спутаны токсичностью аммиака и подкислением среды. (Поглощая аммоний, растения выделяют кислоту). Водные растения иногда выращивают на питательных средах, содержащих от 30 до 60 ppm нитратного азота [6, 47]. При замене нитратов аммонием при таких высоких концентрациях N часто происходит торможение роста или гибель растений [48, 49].
Elodea nuttallii показала гораздо лучший рост на аммонии, чем на нитратах (рис. Vol-2).
рис. Vol-2. Влияние разных источников азота на рост Elodea nuttallii
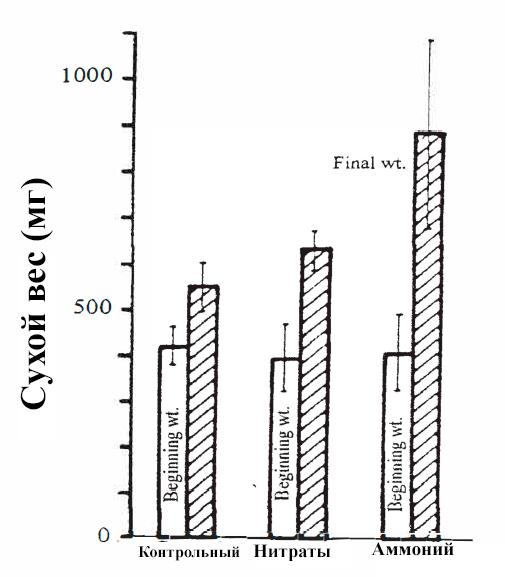
Пять побегов Elodea nuttallii были помещены в емкости с 1 л фильтрованной озерной воды. Столбцы на рисунке показывают начальный и конечный сухой вес растений в 3-х разных условиях. "Контрольный" сосуд содержит озерную воду без добавления азота. "Нитраты" - сосуды с озерной водой плюс 2 мг/л NO3-N. "Аммоний" - сосуды с озерной водой плюс 2 мг/л NH4-N. Конечный сухой вес определялся после 2-х недель роста.
 Родина Elodea nuttallii Северная Америка. Как и E. canadensis, она распространилась по всему миру. Хотя, по-видимому Elodea nuttallii более успешный конкурент по выживаемости в загрязненных водах, чем E. canadensis, эти два вида похожи друг на друга, и в Британии их находили растущими вместе. Как и многие другие водные растения, Elodea nuttallii в качестве источника азота предпочитает аммоний нитратам.
Родина Elodea nuttallii Северная Америка. Как и E. canadensis, она распространилась по всему миру. Хотя, по-видимому Elodea nuttallii более успешный конкурент по выживаемости в загрязненных водах, чем E. canadensis, эти два вида похожи друг на друга, и в Британии их находили растущими вместе. Как и многие другие водные растения, Elodea nuttallii в качестве источника азота предпочитает аммоний нитратам.В таблице VII-4 показаны итоги экспериментальных исследований, сравнивающих рост в зависимости от источника азота.
| Аммоний | Смесь аммоний/нитраты |
|---|---|
| Ceratophyllum demersum [ 48] | Eichhornia crassipes (28] |
| Elodea nuttallii [30] | Marchantia polymorpha (38] |
| Marsilea drummondii [ 48] | |
| Salvinia molesta [ 40] |
В опытах с концентрациями аммония < 40 мг/л все растения лучше росли на аммонии или смеси аммония и нитратов. Скорее всего, эти результаты можно обобщить на большинство водных растений. Если предположить, что растения приспосабливаются к источнику N в своей конкретной естественной среде обитания, то водные растения должны не только предпочитать аммоний, но и лучше расти с ним. (Это предположение объясняется в следующем разделе.)
Экология и предпочтения источников азота
В качестве источников азота для растений аммоний и нитраты имеют свои собственные характерные черты. На каком источнике азота лучше растет тот или иной вид, зависит от того, где он эволюционировал. Виды из мест, где преобладают нитраты, лучше растут на нитратах; виды из местообитаний, где преобладает аммоний, лучше растут на аммонии.
Нитраты преобладают в более сухих наземных почвах. Это потому, что нет недостатка кислорода нитрифицирующим бактериям, быстро преобразующим аммоний в нитраты. Нитраты накапливаются, потому что кислород препятствует удалению нитратов путем денитрификации. Многие наземные растения, особенно сельскохозяйственные, хорошо приспособились к своей богатой нитратами среде и в целом предпочитают нитраты или смесь аммония и нитрата чистому аммонию [50, 51].
Однако в водной среде преобладает аммоний. Это объясняется тем, что почти все грунты, поддерживающие рост водных растений, являются анаэробными. В такой среде накапливается аммоний, а не нитраты, потому что анаэробные условия препятствуют нитрификации и способствуют денитрификации. Поскольку в водной среде преобладает аммоний, большинство видов водных растений выработали питание на его основе.
Исключения, такие как Littorella uniflora, Lobelia dortmanna, Luronium natans и Echinodorus ranunculoides, происходят из сред, которые сильно бедны питательными веществами ("ультраолиготрофные") [52]. Эти среды способствуют нитрификации и накоплению нитратов. Более того, сами растения стимулируют нитрификацию, выделяя корнями большое количество кислорода [33]. Эти четыре вышеуказанных вида, по-видимому, предпочитают поглощение нитратов корнями более распространенному поглощению аммония листьями [22].
В. Вы предлагаете мне добавить аммоний в аквариумы, чтобы растения лучше росли?
О. Нет. Я бы никогда не добавляла аммоний в аквариум; он слишком токсичен и для рыб, и для растений. Обычная аквариумная экосистема постоянно вырабатывает небольшие уровни аммония. Нет нужды добавлять еще.
Я хочу сказать, что растения легко усваивают аммоний из аквариумной воды и, вероятно, используя его, лучше растут. Это означает, что в аквариумах, в которых хорошо растут здоровые растения, биологическую фильтрацию (нитрификацию) можно уменьшить.
Конкурирование растений и нитрифицирующих бактерий
Для производства белков, растения, водоросли и все фотосинтезирующие организмы используют азот аммония (не нитратов).
Первым шагом в важном метаболическом пути GS-GOGAT является связывание NH3 с углеводами. (GS и GOGAT - это сокращения для глутамина и глутамин-оксоглутаратаминотрансфераза). GOGAT работает с ферментом глутаминсинтетазой для связывания аммиака с глутаминовой кислотой с образованием глутамина. Из этого глутамина будут синтезированы все остальные аминокислоты, а затем, в конечном счете, объединены, чтобы сформировать белки растения [54].
Растения превращают нитраты в аммоний («восстановление нитратов»), затрачивая на это энергию. Этот процесс, по-видимому, является зеркальным отображением нитрификации. Нитрифицирующие бактерии получают энергию, необходимую им для своих жизненных процессов, исключительно от окисления аммония до нитратов; общий выход энергии от двух стадий нитрификации составляет 84 ккал/моль [55], а общая реакция такова:
NH4+ + 2O2 => NO3- + 2H+
Растения, по сути, должны расходовать такое же количество энергии (83 ккал/моль), чтобы преобразовать нитраты обратно в аммоний в двухступенчатом процессе восстановления нитратов [50].
NO3- + H2O => NH4+ + 2O2
Растения используют аммоний для синтеза белка. Таким образом, когда нитрифицирующие бактерии превращают аммоний в нитраты, растения вынуждены - при больших затратах энергии - превращать нитраты обратно в аммоний.
В. Наши три 300-литровых высокотехнологичных аквариума в большом количестве загружены рыбой. Для поддержания хорошего состояния рыбы мы ее обильно кормим, поэтому думаем, что нашим системам требуется внешняя биологическая фильтрация. Очевидно, что интенсивно растущие растения не потребляют всего аммония, так как нитраты накапливаются со скоростью 7-10 мг/л в неделю, что требует применения денитраторов и регулярной частичной смены воды для поддержания средней концентрации нитратов менее 10 мг/л.
В двух аквариумах установлены струйные фильтры для дополнительной биологической фильтрации, а в одном - гравийный фильтр. Что касается вашей гипотезы о том, что «биологическая фильтрация может негативно сказаться на растениях», я могу сказать только одно - сомневаюсь. Если наша фильтрация сдерживает рост растений предположительно из-за нехватки аммония по причине быстрой нитрификации, то мне страшно даже представить, как они будут расти в противном случае - в настоящее время мы вынуждены обрезать и пропалывать растения каждые две недели.
О. Ваше наблюдение, что растения процветают несмотря на струйные фильтры никак не доказывает того, что они не росли бы лучше без них. Подозреваю, что любое возможное влияние струйных фильтров на растения нивелируется идеальными условиями выращивания в ваших «высокотехнологичных» аквариумах.
И тот факт, что в ваших аквариумах накапливаются нитраты, не означает, что растения не поглощают аммоний. Как и ожидалось, растения игнорируют менее желательные нитраты, поскольку они конкурируют с бактериями фильтра за аммоний. Только измеряя уровень аммиака (а не нитратов) при постепенном снижении биологической фильтрации, можно определить, сколько нитрификации действительно необходимо для данного количества рыб в ваших аквариумах.
Относительно быстрое накопление нитратов в ваших аквариумах может быть скорее из-за интенсивной биологической фильтрации, чем из-за плотной посадки рыбы. Если бы не было струйных фильтров, то растения, возможно, удаляли бы больше общего азота и предотвращали бы накопление нитратов. Это происходит потому, что растения могут накапливать больше азота в своих тканях тогда, когда получают его в виде аммония, а не в виде нитратов [39].
Удивляюсь, как на самом деле мало нужно биологической фильтрации моим аквариумам. Когда, удалив фильтрующие элементы из канистровых фильтров, я уменьшила биологическую фильтрацию, у меня стало меньше проблем с накоплением нитратов и подкислением воды.
Нитрификация необходима в аквариумах без растений. В растительных же аквариумах она гораздо менее важна. Моя точка зрения состоит не в том, чтобы полностью отказаться от фильтров, но я бы настоятельно призвала читателей верить в свои растения больше, чем в струйные фильтры.
Жесткость воды и экология растений
Если вы путешествуете по речным системам Каролины вниз к побережью, то наблюдаете, как меняется вода от мягких вод болот и топей, кипарисовых болот и темноводных ручьев с почти нулевой жесткостью до жестких солоноватых вод из-за приливного притока морской воды.
Морская вода содержит 412 ppm Ca и 1300 ppm Mg, что делает ее жесткой и "соленой".
Меняется и растительность. Обычные для мягких вод аквариумные растения, такие как Echinodorus tenellus, Ludwigia repens, Bacopa caroliniana и Sagittaria graminea, в жестких и/или солоноватых водах уступают место Bacopa monnieri, Sagittaria subulata и Ricciafluitans [56].
Водные виды растений научились выживать в своей конкретной среде обитания, развивая адаптивные физиологические механизмы.
Например, Bacopa monnieri, аквариумное растение, которое происходит из солоноватых вод, как известно, переносит высокие уровни солей. Так, исследователи успешно адаптировали растения (в течение 12-недельного периода воздействия возрастающих концентраций солей) до 15000 мг/l NaCl [57].
Через некоторое время эти механизмы становятся в той или иной степени генетически закрепленными. Таким образом, водные виды растений оказываются не одинаковы по своим требованиям. Многие мягководные виды растений и амфибии могут поглощать только CO2 и не могут поглощать карбонаты. Растения жестких вод могут поглощать карбонаты, но по-видимому нуждаются в большем количестве кальция в воде, чем мягководные.
Жесткость воды является главной объединяющей темой. Хотя, строго говоря, жесткость воды определяют Ca и Mg, другие макроэлементы (K, Na, S, Cl, бикарбонаты) и другие факторы (щелочность, рН, удельная проводимость) обычно связаны с жесткостью воды в природных пресных водоемах.
Удельная проводимость - это точная мера электрической проводимости воды ионами, но она также отражает уровни "питательных веществ жесткой воды" [58]. Это происходит потому, что питательные вещества жесткой воды существуют в ней в виде ионов (например , Ca2+, Mg2+, K+, Na+, Cl-, HCO3-, HSO4-), которые все проводят электричество в воде.
Один исследователь [59] исследовал химический состав воды и виды водных растений в 700 различных мест Японии, где вода варьировалась от мягкой до чрезвычайно жесткой, солоноватой. Регистрировалось, были ли рН, щелочность, Ca и удельная проводимость выше (или ниже) там, где растения присутствовали, или там, где они отсутствовали. Из 20 изученных видов большинство растений показали существенную связь со всеми четырьмя параметрами. Например, Myriophyllum spicatum был обнаружен в местообитаниях с жесткой водой и высокой удельной проводимостью, а Brasenia schreberi - в местообитаниях с мягкой водой и низкой удельной проводимостью (табл. VII-5).
табл. VII-5
| Химический состав воды | Myriophyllum spicatum (диапазон) |
Brasenia schreberi (диапазон) |
|---|---|---|
| Щелочность (как ppm CaCO3) | 13 - 145 | 2.5 - 47 |
| Кальций (мг/л) | 27 - 61 | 0.4 - 22 |
| pH | 65 - 96 | 5.6 - 87 |
| Проводимость (мкС/см, 25°C) | 55 -15100 | 15 - 238 |
Хотя существует некоторое совпадение между этими двумя видами по всем 4 параметрам, но то, что отличает их друг от друга - это крайности. Myriophyllum spicatum встречается в воде с проводимостью 15100 мкС/см, тогда как Brasenia schreberi не была обнаружена ни в одной воде с проводимостью выше 238 мкС/см. Жестководный M. spicatum не был обнаружен в воде с уровнем кальция менее 2.7 мг/л, в то время как мягководная Brasenia schreberi была найдена в воде со всего лишь 0.4 мг/л кальция. Неудивительно, что нескольким жестководным растениям абсолютно необходимо 1 - 2 ppm кальция в воде (см. следующий раздел).
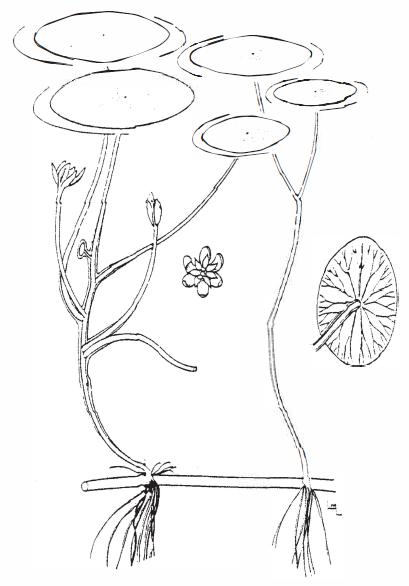 Brasenia schreberi (водный щит). B. schreberi - это вид водяных лилий, чьи подводные черешки покрыты желеобразной слизью. Эти, распространенные по всему миру растения, живут в такой мягкой воде, в которой жестководные растения, пожалуй, не выживут. Так мягководные растения, большинство из которых медленнорастущие, занимают экологическую нишу в бедных питательными веществами средах.
Brasenia schreberi (водный щит). B. schreberi - это вид водяных лилий, чьи подводные черешки покрыты желеобразной слизью. Эти, распространенные по всему миру растения, живут в такой мягкой воде, в которой жестководные растения, пожалуй, не выживут. Так мягководные растения, большинство из которых медленнорастущие, занимают экологическую нишу в бедных питательными веществами средах.Потребности жестководных растений
Водные растения из жестких вод редко встречаются в мягкой кислой воде, потому что они требуют определенного уровня Ca, бикарбонатов, K и Mg (так называемые "питательные вещества жесткой воды").
К примеру, Хьюберт [68] обнаружил, что Ca, Mg и K, наличествующие в воде, в значительной степени влияют на рост, выживаемость и цветение жестководного растения Potamogeton pectinatus (табл. VII-6) .
Таблица VII-6. Влияние отсутствующих в воде питательных веществ на Potamogeton pectinatus [68].
| Питательные вещества, отсутствующие в воде | Рост (в процентах от контрольного) |
Цветение (соцветия/г сухого веса) |
|---|---|---|
| Нет (контрольный сосуд со всеми питательными веществами) | 100% | 1.6 - 3 |
| Азот | 100 | 1.6 - 3 |
| Сера | 100 | 1.6 - 3 |
| Микроэлементы (Fe, Cu, Zn, Mn, и пр.) | 100 | 1.6 - 3 |
| Калий | 45 | 0.7 |
| Магний | 53 | 0.7 |
| Кальций | Гибель | Гибель |
Растения выращивали в сосудах, содержащих одинаковый богатый озерный грунт, но разные питательные среды. Озерный грунт покрыт слоем песка толщиной 1 дюйм (2.5 см).(Исследователи не обнаружили вымывания питательных веществ из грунта в воду.)
Растения, выращенные на питательных средах, где азот был удален из воды, росли и цвели так же хорошо, как и растения в контрольном резервуаре. Это было также верно для растений, выращенных в резервуарах без серы или без микроэлементов в воде. (Все эти элементы растения могли извлекать из богатого грунта, в который они были посажены). Однако растения, выращенные в средах без калия, росли и цвели примерно в два раза медленнее, чем в контрольном резервуаре. Удаление из воды магния имело такой же эффект. Но наиболее впечатляющий эффект наблюдался у растений, выращенных в среде с отсутствующим кальцием. Без кальция (~2 ppm) растения погибали в течение недели.
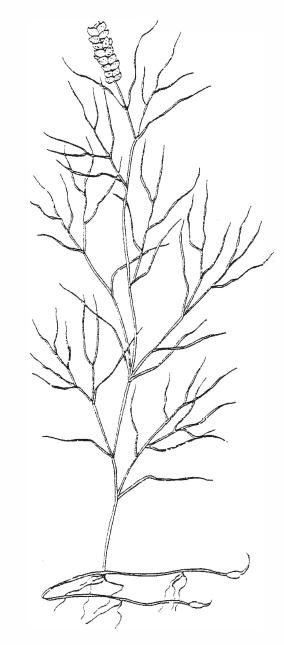
Potamogeton pectinatus. P. pectinatus необходимы Mg, K и Ca в воде, а не только в субстрате. Действительно, без какого-либо присутствия кальция в воде он погибает. Этим может объясняться тот факт, почему P. pectinatus, который распространился по всему миру, никогда не встречается в средах обитания с мягкой водой. Другие жестководные растения показали такую же потребность кальция в воде.
Действительно, отсутствие кальция в воде часто приводит к гибели жестководных растений. Водяные гиацинты в отсутствие кальция в воде погибали в течение 2-х недель [69]. Отсутствие других питательных веществ N, K, P, Mg, S и Fe просто приводило к симптомам дефицита и замедлению роста. Когда Lemna trisulca (Ряску трехдольную) помещали в питательную среду с уровнем Ca менее 1 ppm, она либо погибала, либо деформировалась.
Водяная лилия Nymphoides peltata никогда не встречается в местообитаниях с мягкой водой. Исследователи [71] установили, что для этого растения должно иметься некоторое количество Ca в воде чтобы стебель мог нормально расти. В условиях отсутствия примерно 1 ppm кальция, молодые растения не могли поднять свои листья над поверхностью воды и погибали, вероятно, от удушья.
Водяные лилии, чтобы выжить в сильно анаэробных грунтах, где они часто встречаются, полагаются на интенсивное аэрирование своего субстрата. Они должны иметь по крайней мере два листа над водой, чтобы вентилировать корневую зону.
Вообще, большинство растений происходящих из водоемов с жесткой водой могут использовать бикарбонаты в качестве альтернативного источника углерода. Однако некоторым жестководным растениям, по-видимому, нужны бикарбонаты в воде для большей цели, чем просто фотосинтетический углерод. Так Vallisneria americana даже при интенсивной продувке CO2 росла на 40% лучше, когда питательные среды содержали бикарбонаты, чем когда их не было. А Myriophyllum spicatum был гораздо менее восприимчив к нападению грибка, когда в питательную среду добавляли бикарбонаты [72].
Тяжелых металлов, в состав которых входят такие микроэлементы, как железо и медь, часто не хватает в щелочной жесткой воде, поскольку они образуют (или осаждаются) оксиды металлов [73]. Например, в одном исследовании Fe2+ оставался в растворе в течение 13 ч при рН 6.3, но только 34 мин при рН 8 [74]. Как только металлы выпадают в осадок, они становятся менее доступными растениям. Скорее всего, растения со временем приспособились к этим условиям, развив мощные физиологические механизмы для извлечения дефицитных микроэлементов из окружающей среды. Вероятно, жестководным растениям требуется меньше микроэлементов в воде, чем мягководным. В то же время, однако, жестководные растения не "научились" защищать себя от избытка тяжелых металлов и могут быть особенно восприимчивы к токсичности металлов.
Потребности мягководных растений
К сожалению, существует гораздо меньше экспериментальных данных в отношении мягководных растений, многие из которых являются тропическими растениями, содержащимися в аквариумах. Но я все же хотела бы выдвинуть гипотезу об их экологии и требованиях. Во-первых, мягководные растения происходят из мест обитания бедных такими питательными веществами, как Ca, Mg, K и S. Как следствие, они были вынуждены разработать высокоэффективные механизмы для извлечения этих питательных веществ из окружающей среды.
Я сравнила рост мягководной Bacopa caroliniana с жестководной Bacopa monnieri в питательных средах с добавлением Ca и без него. (В этом эксперименте растения выращивались в отдельных банках, содержащих горшечную почву, покрытую гравием, и им позволялось расти в полупогруженном состоянии). Без кальция Bacopa monnieri распалась. С кальцием она росла довольно хорошо. Мягководная B. caroliniana напротив, хорошо росла и выглядела нормально в обоих экспериментальных условиях.
Кислотность часто ассоциируется с местообитаниями бедными кальцием, а кислая вода содержит мало бикарбонатов. Eriocaulon decangulare и другие растения изоэтидного типа, происходящие из водоемов с чрезвычайно мягкой водой, не могут использовать бикарбонаты в качестве источника углерода [75].
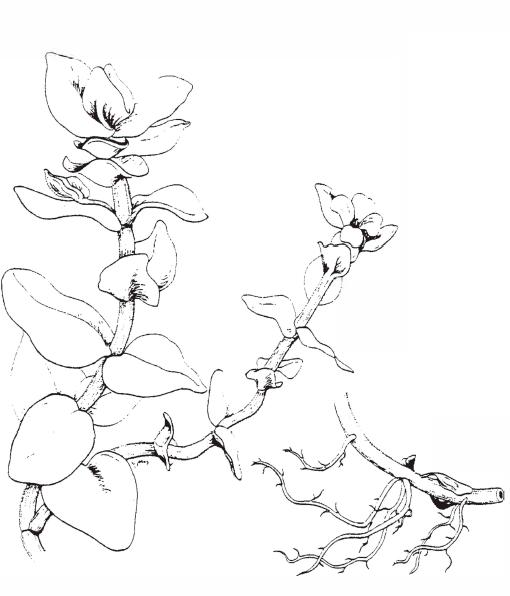 Bacopa caroliniana. Я нашла B. caroliniana, буйно растущую в Каролинском болоте с рН 4.8 и GH < 1. В моих экспериментах этот вид чувствовал себя гораздо лучше в условиях недостатка кальция, чем Bacopa monnieri, которая происходит из жестких, солоноватых вод.
Bacopa caroliniana. Я нашла B. caroliniana, буйно растущую в Каролинском болоте с рН 4.8 и GH < 1. В моих экспериментах этот вид чувствовал себя гораздо лучше в условиях недостатка кальция, чем Bacopa monnieri, которая происходит из жестких, солоноватых вод.При попытках понять требования мягководных растений, возникает один вопрос. Действительно ли мягководные растения предпочитают водные и почвенные условия своей естественной среды обитания, несмотря на то, что она часто бедна питательными веществами и содержит много тяжелых металлов?
Я решила проверить эту гипотезу, сравнив рост различных мягководных и жестководных видов растений в двух совершенно различных почвенно-водных условиях. Каждый вид растений помещен в свою собственную экспериментальную банку, поэтому ему не пришлось конкурировать с другими видами растений. "Кислая среда" состояла из мягкой водной питательной среды и кислого субстрата (смесь сфагнового торфа и песка в соотношении 1 : 2 с конечным рН = 4). "Щелочная среда" состояла из жесткой водной питательной среды и щелочной почвы (пустынная почва из Аризоны с конечным рН = 8.0). Рост растений в течение 6-недельного эксперимента показан в таблице VII-7.
Таблица Vii-7. Рост различных видов в условиях кислой и щелочной среды
| Виды растений | Рост (% прироста) |
|
|---|---|---|
| Кислая среда | Щелочная среда | |
| Bacopa caroliniana | 43 | 84 |
| Bacopa monnieri | 22 | 49 |
| Sagittaria graminea | 68 | 145 |
| Ludwigia repens | -4 | 78 |
| Vallisneria spiralis | 0 | 520 |
Каждая экспериментальная единица (банка с растениями) была реплицирована три раза. По истечении 6 недель все растения были вымыты, высушены и взвешены. Конечный вес сравнивали с начальным сухим весом, определенным ранее. Для B. caroliniana, L. repens и V. spiralis различия в среднем росте между этими двумя состояниями были статистически значимыми (Р < 0.05).
Два вида из местообитаний с мягкой водой, B. caroliniana и S. graminea, росли сравнительно хорошо в кислой среде, но еще лучше в щелочной. Например, средний прирост B. caroliniana в щелочной среде составил 84%, а в кислой 43%. Другое мягководное растение Ludwigia repens вообще не росло в кислой среде, но хорошо росло в щелочной.
Результаты для жестководных растений были не такие однозначные. Vallisneria spiralis, как и ожидалось из-за ее жестководного происхождения, великолепно росла в щелочных условиях с 3 оригинальными растениями среднего размера, увеличив свою биомассу на 520% и энергично размножаясь. Однако в кислой среде валлиснерия определенно боролась за жизнь, и хорошо если не погибала до конца эксперимента (рис. VII-3).
Рисунок VII-3. Рост Vallisneria spiralis в условиях кислой и щелочной среды
 Большинство Валлиснерий выходцы из мест обитания с жесткой водой. В эксперименте, где я выращивала V. spiralis в жесткой воде и щелочной почве пустыни, одно маленькое растение за 6 недель увеличило свою биомассу более чем на 500% и произвело в среднем 8 деток (правая банка). А в мягкой кислой воде и кислом торфяном субстрате V. spiralis распадалась (левая банка).
Большинство Валлиснерий выходцы из мест обитания с жесткой водой. В эксперименте, где я выращивала V. spiralis в жесткой воде и щелочной почве пустыни, одно маленькое растение за 6 недель увеличило свою биомассу более чем на 500% и произвело в среднем 8 деток (правая банка). А в мягкой кислой воде и кислом торфяном субстрате V. spiralis распадалась (левая банка).Bacopa monnieri, другое жестководное растение, росло медленно и оставалось в погруженном состоянии как в кислой, так и в щелочной среде, вероятно, из-за недостатка CO2.
Когда я начала этот эксперимент, я предполагала, что растения с мягкой водой предпочтут условия их естественной среды обитания. В конце концов, именно к этому они и привыкли. Однако мягководные растения повели себя вопреки моему предположению. Они лучше всего росли в щелочной среде, которая, должна бы быть им совершенно незнакома.
Объяснением этой аномалии может быть то, что мягководные растения растут в природе в мягкой воде, потому что это единственная среда обитания, где они могут эффективно конкурировать с жестководными растениями, многие из которых используют бикарбонаты и могут расти гораздо быстрее.
Питание растений в аквариуме
Мой эксперимент (таблица VII-7) и тот факт, что многие питомники водных растений успешно выращивают мягководные криптокорины, апоногетоны и т. д. в жесткой щелочной воде, противоречат благонамеренным попыткам водных садоводов выращивать мягководные растения в мягкой воде. Идея о том, что мягкая вода оптимальна для многих аквариумных растений широко распространена. Я слышала, как многие любители грешат на свою жесткую водопроводную воду, как на причину плохого роста растений в их аквариумах.
На мой взгляд, единственное, что могло бы сдерживать рост мягководных растений в жесткой воде - это малое количество CO2 . Как правило, высокий рН превращает большую часть CO2 в бикарбонаты, а мягководные растения в основном не умеют их использовать.
Таким образом, если мягководные растения вынуждены конкурировать за углерод с жестководными растениями в одном и том же резервуаре, мягководным растениям может прийтись плохо.
Исключений, впрочем, предостаточно. Например, если мягководным растениям-амфибиям, типа Ludwigia repens, позволить расти в полупогруженном состоянии и использовать CO2 воздуха, они будут чувствовать себя прекрасно.
Комментарий. Что ж, то, что вы написали в этой главе, интересно, но не очень полезно. Ничего не говорится, какие удобрения использовать или как заставить мои растения расти лучше.
Ответ. Если ваша вода не слишком мягкая, и в аквариуме в качестве субстрата используется плодородная почва, и вы хорошо кормите рыбу и чистите аквариум и меняете воду по минимуму, ваши растения получат все необходимые им питательные вещества. Удобрения действительно нужны только в определенных ситуациях, таких как выращивание их в аквариумах с подачей CO2 и/или мягкой водой.
В этой главе я вижу три посыла. Во-первых, биологическая фильтрация (нитрификация) в растительном аквариуме может быть уменьшена, потому что растения легко поглощают аммоний.
Во-вторых, мягкая вода - это вода, бедная питательными веществами, и она не идеальна для растений, даже тех, которые происходят из водоемов с мягкой водой. А жестководные растения могут просто не выжить в ней.
В-третьих, я бы настоятельно призвала начинающих любителей, особенно тех, у кого жесткая вода, не дискриминировать быстрорастущие жестководные растения. При жесткой водопроводной воде грех не воспользоваться плодовитыми жестководными растениями, такими как роголистник, элодея и валлиснерия.
Литература
1. Hopkins WG. 1995. Introduction to Plant Physiology. John Wiley (NY), Ch. 4.
2. Glass ADM. 1989. Plant Nutrition: An Introduction to Current Concepts. Jones & Bartlett Publishers
(Boston), Ch. 8.
3. Wild A and Jones LHP. 1988. Mineral nutrition of crop plants. In: Wild A (ed), Russell's Soil Conditions
and Plant Growth (11th Edition). John Wiley (NY), pp 69-112.
4. Basiouny FM, Garrard LA. and Haller WT. 1977. Absorption of iron and growth of Hydrilla verttcillara
(L.F.) Royle. Aquat. Bot. 3: 349-356.
5. Beck T and Feller U. 1991. .Ammonium-stimulated K release from Lemna minor L. grown on a medium
containing nitrate as N-source. Aquat. Bot. 255-266.
6. Gerloff GC. 1975. Nutritional Ecology ofNuisance Aquatic Plants. National Environmental Research
Center (Corvallis OR), 78 pp.
7. Madsen TV and Sondergaard M. 1983. The effects of current velocity on the photosynthesis of Callitriche
stagnalis Scop. Aquat. Bot. 15: 187-193.
8. Boeger RT. 1992. The influence of substratum and water velocity on growth of Ranunculus aquatilis
L. (Ranuncu!aceae). Aquat. Bot. 42: 351-359.
9. Barko I'W, Gunnison D, and Carpenter SR. 1991a. Sediment interactions with submersed macrophyte
growth and community dynamics. Aquat. Bot. 41: 41-65.
10. Wetzel RG. 1983. Limnology (Second Ed.). Saunders College Publishing (Philadelphia, PA), pp.
232, 256.
11. DeMarte JA and Hartman RT. 1974. Studies on absorption of 32P, 59Fe, and 45Ca by Water-Milfoil
(Myriophyllum exalbescens fomald). Ecology 55: 188-194.
12. Pedersen 0. 1993. Long-distance water transport in aquatic plants. Plant Physiol. 103: 1396-1375.
13. Pedersen O and Sand-Jensen K. 1997. Transpiration does not control growth and nutrient supply in
the amphibious plantMentha aquatica. Plant Cell Environ. 20: 117-123.
14. Bristow JM and Whitcombe M. 1971. The role ofroots in the nutrition of aquatic vascular plants.
Am. 1. Bot. 58: 8-13.
15. Carignan Rand Kalff J. 1980. Phosphorus sources for aquatic weeds: Water or sediments? Science
20.7: 987-988.
16. Moeller RE, Burkholder JM, And Wetzel RG. 198 8. Significance of sedimentary phosphorus to a
rooted submersed macrophyte (Naja flexilis (Willd.) Rostk. and Schmidt) and its algal epiphytes.
Aquat. Bot. 32: 261-281.
17. Fassett NC. 1957. A Manual of Aquatic Plants. The University of Wisconsin Press (Madison WI)
18. Barko I'W, Smart RM, McFarland DG, and Chen RL. 1988. Interrelationships between the growth of
Hydrilla verticllata (L.F.) Royle and sediment nutrient availability. Aquat. Bot. 32: 205-216.
19. Sutton DL and Latham WGH. 1996. Analysis of interstitial water during culture of Hydrilla verticillata
with controlled release fertilizers. Aquat. Bot. 54: 1-9.
20. Carignan R. 1985. Nutrient dynamics in a littoral sediment colonized by the submersed macrophyte
Myriophyllum spicatum. Can. J. Fish. Aquat. Sci. 42: 1303-1311.
21. Iizumi Hand Hattori A. 1982. Growth and organic production of eelgrass (Zostera marina L.) in
temperate waters of the pacific Coast of Japan. III. The kinetics of nitrogen uptake. Aquat. Bot. 12:
245-256.
22. Schuurkes JAAR Kok CJ, and Hartog CD. 1986. Ammonium and nitrate uptake by aquatic plants
from poorly buffered and acidified waters. Aquat. Bot. 24: 13 1-146.
23. Thursby GB and Harlin MM. 1982. Leaf-root interaction in the uptake of ammonia by Zostera marina.
Mar. Biol. 72: 109-112.
24. Pedersen MF, Paling EI, and Walker DL. 1997. Nitrogen uptake and allocation in the seagrass Amphibolis
antarctica. Aquat. Bot. 56: 105-117.
25. Nichols DS and Keeney DR. 1976. Nitrogen nutrition oUvfyriophyllum spicatum: Uptake and
translocation of 15N by shoots and roots. Freshwater Biol. 6: 145-154.
26. Schwoerbel VJ and Tillmanns GC. 1972. Adaptation to ammonia in situ by submerged macrophytes.
Arch. HydrobioL 42: 139-141. (German)
27. Toetz DW. 1971. Diurnal uptake of NO3 and NH4 by a Ceratophylllum-periphyton community.
Limnol. Oceanogr. 16: 819-822.
28. Reddy KR and Tucker JC. 1983. Productivity and nutrient uptake of water hyacinth, Eichhornia
crassipes. I. Effect of nitrogen source. Econ. Bot. 37: 237-247.
29. Reddy KR, Tucker JC, and DeBusk WF. 1987. The role of Egerta in removing nitrogen and phosphorus
from nutrient enriched waters. J. Aquat. Plant Manage. 25: 14-19.
30. Ozimek T, Gulati RD, and van Dank E. 1990. Can macrophytes be useful in biomanipulation of
lakes: The Lake Zwemlust example. Hydrobiologia 200: 399-407.
31. Schwoerbel VJ and Tillmanns GC. 197 4. Assimilation of nitrogen from the medium and nitrate reductase
activity in submerged rnacrophytes: Fontinalis anttpyretica L. Arch. Hydrobiol. Sup. 47:
289-294.
32. Reddy KR 1983. Fate of nitrogen and phosphorus in a waste-water retention reservoir containing
aquatic macrophytes. J. Environ. Qual. 12: 137-141.
33. Roelofs JGM, Schuurkes J AAR, and Smits AJM. 1984. Impact of acidification and eutrophication on
macrophyte communities in soft waters II. Experimental studies. Aquat. Bot. 18: 3 98-411.
34. Miyazaki T and Satake K. 1985. In st tu measurement of uptake of inorganic carbon and nitrogen by
the aquatic liverworts Jungermannia vulcanicola Steph. and Scapania undulata (L.) Dum. in an acid
stream, Kashiranashigawa, Japan. Hydrobiologia 124: 29-34.
35. lngemarsson B, Johansson L, and Larsson C-M. 1984 .. Photosynthesis and nitrogen utilization in exponentially
growing nitrogen-limited cultures of Lemna gibba. Physiol. Plant. 62: 363-369.
36. UBrich WR, Larsson M, Larsson CM, Lesch S, and Novacky A. 1984. Ammonium uptake in Lemna
gibba G 1, related membrane potential changes, and inhibition of anion uptake. Physic!. Plant 61:
369-376.
37. Porath D and Pollock J. 1982. Ammonia stripping by duckweed and its feasibility in circulatin.g
aquaculture. Aquat. Bot. 13: 125-131.
38. Katoh K, Ishikawa M, Miyake K, Ohta Y, Hirose Y, and Iwamura T. 1980. Nutrient utilization and
requirement under photoheterotrophic growth of Marchantia polymorpha: improvement of the culture
media. Physiol. Plant. 49: 241-247.
39. Nelson SG, Smith BD, and Best BR. 1980. Nitrogen uptake by tropical freshwater macrophytes.
Technical Report by Water Resources Research Center of Guam Univ. Agana. (Available from National
Technical Information Service (NTIS), Springfield VA 22161 as PB80-194228.)
40. Cary PR and Weerts PGJ. 1983. Growth of Salvinia molesta as affected by water temperature and
nutrition. 1. Effects of nitrogen level and nitrogen compounds. Aquat. Bot. 16: 163-172.
41. Jauhiainen J, Wallen B, and Maimer N. 1998. Potential NH4+ and NO3- uptake in seven Sphagnum
species. New Phytol. 138: 287-293.
42. Ferguson AR and Bollard EG. 1969. Nitrogen metabolism of Spirodela oligorrhiza 1. Ctilization of
ammonium, nitrate and nitrite. Planta 88: 344-352.
43. Short FT and McRoy CP. 1984. Nitrogen uptake by leaves and roots of the seagrass Zostera marina
L. Bot. Mar. 27: 547-555.
44. Kansas State Teachers College. 1967. Common Aquatic weeds of Kansas Ponds and Lakes. The
Emporia State Research Studies.
45. Guerrero MG, Vega MJ, and Losada M. 1981. The assimilatory nitrate-reducing system and its
regulation. A..-inu. Rev. Plant Physic!. 32: 169-204.
46. Dortch Q. 1990. The interaction between ammonium and nitrate uptake in phytoplankton. Mar. Ecol.
Prog. Ser. 61: 183-201.
47 Kane ME, Gilman EG, Jenks MA, and Sheehan TJ. 1990. Micropropagation of the aquatic piant
Cryptocoryne lucens. HortScience 25: 687-689.
48 Edwards PSJ and Allsopp A I 956. The effects of changes in the inorganic nitrogen supply on the
growth and development of marsilea in aseptic culture. J. Exp. Bot 7: 194-202.
49. Best EPH. 1980. Effects of nitrogen on the growth and nitrogenous compounds of Ceratophyllum
demersum. Aquat. Bot. 8: 197-206.
50. Lewis OA.1\1. 1986. Plants and Nitrogen. Edward Arnold Publishers, LTD. Baltimore, MD, pp. 27-
29.
51. Hageman RH. 1980. Effect of form of nitrogen on plant grov.th. In: Meisinger JJ, Randall GW, and
Vitosh ML (eds). Nitrification [nhibitors- Potentials and Limitations. Am.Sac. of Agronomy (Madison WI), pp. 47-62.
52. Arts GHP, Roelofs JGM, and De Lyon MIB. 1990. Differential tolerances among soft-water macrophyte
species to acidification. Can. J. Bot. 68: 2127-2134.
53. Preston CD and Croft JM. 1997. Aquatic Plants in Britain and Ireland. B.H. & A. Harley Ltd (Essex,
England).
54. Lewis 1986, pp. 34-41.
55. Wetzel 1983, pp. 235.
56. Botanist Patrick McMillan (personal communication 1997).
57. Ali G, Purohit M, Saba, Iqbal M, and Sriva:,"tava PS. 1997. Morphogenic response and isozymes of
Bacopa monniera (L) Wettst cultures grown under salt stress. Phytomorphology 47: 97-106.
58. Wetzel 1983, p. 182.
59. Kadono Y. 1982. Occurrence of aquatic macrophytes in relation to pH, alkalinity, Ca+-+, c1- and conductivity.
Jpn. J. Ecol. 32: 39-44.
60. Catling PM, Freedman B, Stewart C, Kerekes JJ, and Lefkovitch LP. 1986. Aquatic plants of acid
lakes in Kejimkujik National Park, Nova Scotia; floristic composition and relation to water chemistry.
Can. J. Bot. 64: 724- 729.
61. Seddon B. 1972. Aquatic macrophytes as limnological indicators. Freshwater Biol. 2: 107-130.
62. IF AS Aquatic plant line drawings are the copyright property of the University of Florida Center for
Aquatic Plants (Gainesville). Used with pennission.
63. Coulter GW. 1991. Lake Tanganyika and its Life. Oxford University Press (NY), pp 215-218.
64. Ferguson RL, Rivera JA, and Wood LL. 1989. Submerged aquatic vegetation in the AlbemarlePamlico
Estuarine System. Project No. 88-10 of the National Marine Fisheries Service, NOAA,
(Beaufort NC).
65. Fraser D, Morton JK, and Jui PY. 1986. Aquatic vascular plants in Sibley Provincial Park in relation
to water chemistry and other factors. Can. Field-Naturalist 100: 15-2 l.
66. Pip E. 1984. Ecogeographical tolerance range variation in aquatic macrophytes. Hydrobiologia 108:
37-48.
67 Moyle JB. 1945. Some chemical factors influencing the distribution of aquatic plants in Minnesota.
Am. Mid. Nat. 34: 402-420.
68. Huebert DB and Gorham PR. 1983. Biphasic mineral nutrition of the submersed aquatic macrophyte
Potamogeton pectinatus L. Aquat. Bot. 16: 269- 284.
69. Newman S and Haller WT. 1988. Mineral deficiency symptoms of waterhyacint. J. Aquat. Plant
Manage. 26: 55-58.
70. Huebert DB and Shay JM. 1991. The effect of external phosphorus, nitrogen and calcium on growth
of Lemna trisulca. Aquat. Bot. 40: 175-183.
71. Smits AJM, Schmitz GHW, and van der Velde G. 1992. Calcium-dependent lamina production of
Nymphotdes peltata (Gmel.) 0. Kuntze (Menyanthaceae): Implications for distribution. J. Exp. Bot.
43: 1273-128 l.
72. Smith CS. 1993. A bicarbonate-containing medium for the solution culture of submersed plants.
Can. J. Bot. 71: 1584-1588.
73. Wetzel 1983, p. 309.
74. Anderson MA and Morel FMM. 1982. The influence of aqueous iron chemistry on the uptake of iron
by the coastal diatom Thalassiostra weissjlogii. Lirnnol. Oceanogr. 27: 789-813.
75. Raven JA, Handley LL, Macfarlane JJ, Mcinroy S, McKenzie L, Richard JH, and Samuelsson G.
1988. The role of CO2 uptake by roots and CAM in acquisition of inorganic C by plants of the isoetid
life-form: A review, with new data on Eriocaulon decangulare L. New Phytol. 108: 125-148.




***
Комментарии: