Диана Вальштад. Почва.
Diana L. Walstad "Ecology Of The Planted Aquarium"
Использование почвы в аквариумах является прочным идеологическим барьером для многих аквариумистов. Здесь я называю почвой ту землю, которую обычные садоводы используют на грядках или в цветочных горшках. (Я не называю почвой подпочвенный слой, вермикуллит, гончарную глину, наполнитель для кошачьего туалета или гравий).
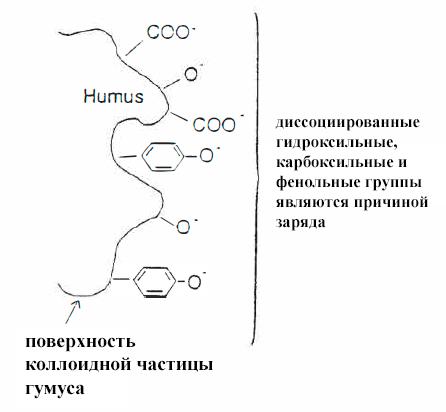
Гумус составляет 60 - 80% органического вещества почв суши [5] и около 25% всего органического вещества озерных отложений [6]. Он приносит пользу растениям, делая более доступными питательные вещества в почвенном растворе и защищая корни растений от токсичности металлов.
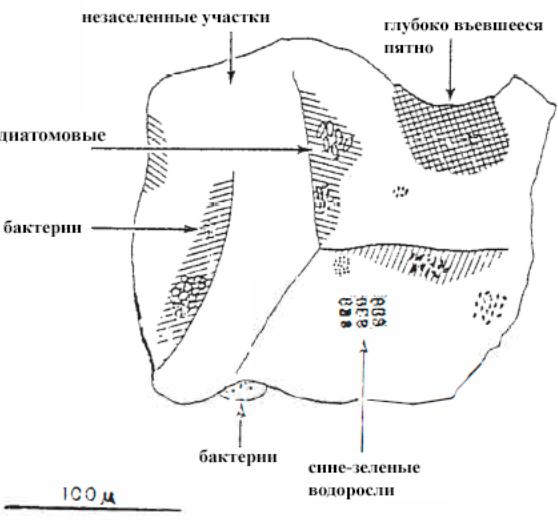 Штриховкой обозначены участки, окрашенные при обработке песка различными гистологическими пятнами; окрашенные участки, скорее всего, представляют собой вкрапленное органического вещества. Линия внизу соответствует 100 мкм, что эквивалентно 0.1 мм.
Штриховкой обозначены участки, окрашенные при обработке песка различными гистологическими пятнами; окрашенные участки, скорее всего, представляют собой вкрапленное органического вещества. Линия внизу соответствует 100 мкм, что эквивалентно 0.1 мм.

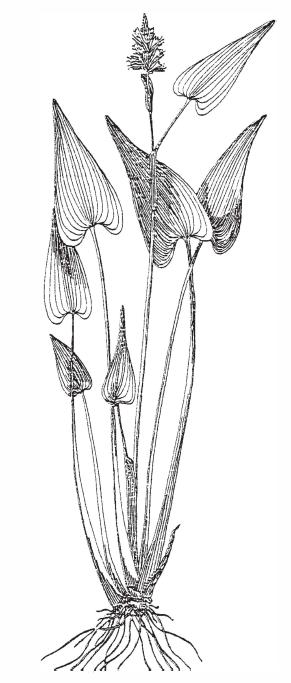 Pontederia cordata. P. cordata обитает на мелководьях востока США. Исследователи установили, что ее корни очень помогали окислять метан. (Водные растения влияют на субстрат, выделяя корнями кислород и органические соединения.)
Pontederia cordata. P. cordata обитает на мелководьях востока США. Исследователи установили, что ее корни очень помогали окислять метан. (Водные растения влияют на субстрат, выделяя корнями кислород и органические соединения.)
Считаю, что риск использовании почвы в аквариуме сильно преувеличен. Если в почве растут наземные растения, будь то сорняки или цветы, то в ней можно выращивать и водные растения. А проблемы, возникающие иногда из-за почвы, как правило, временны и решаемы.
Безусловно, использование в аквариуме неизвестной почвы рискованно. Даже если с ней все в порядке, она может не работать. В сочетании с неподходящим освещением и/или неподходящими растениями почва может стать причиной катастрофы. С другой стороны, стандартный метод - использование простого, промытого гравия - почти гарантирует неудачу при выращивании растений в аквариуме.
В. Мои растения никогда толком не растут. Эхинодорус амазонский постепенно мельчает, пока совсем не погибнет. Анубиасы растут медленно, их листья появляются и вскоре увядают. Криптокорины хоть и плодятся, но остаются небольшими и приземистыми.
Аквариуму, объемом 45 галл (170 л), полтора года. Население - 17 скалярий и 13 разных донных рыбок. 4 дюйма (10 см) гравия, донный фильтр, две люминесцентные лампы по 40 Ватт с отражателями. Продолжительность освещения более 12 часов. Еженедельные 30% подмены воды. Что делать?
О. Ваши растения, вероятно, голодают. Но если вы добавите в воду удобрения, вы, скорее всего, просто получите вспышку водорослей. Думаю, что в этом аквариуме у вас никогда не будут хорошо расти растения. Субстрат слишком бедный или, возможно, чересчур аэробный из-за гравийного донного фильтра. Ваша ситуация типична. Я бы запустила его заново с почвой в качестве грунта, либо распрощалась бы с попытками растить растения.
Состав почв и донных отложений
Почвы (наземные) и донные отложения (водные) состоят из:
1. минеральных частиц
2. органического вещества
3. осадка неорганических веществ
4. микроорганизмов
1. Минеральные частицы [1, 2]
Четыре наиболее распространенных элемента земной коры - кислород, кремний, алюминий и железо - образуют минеральную «основу» (песок, ил и глина) всех почв. Песок, ил и глина различаются не только размерами, но и составом. Песок, в основном, это крошки кварца (диоксид кремния). Ил может представлять собой продукт разрушения камней, либо скопления глины. Глина же состоит из крошечных частичек силиката алюминия.
Другие минералы, такие как оксиды железа, алюминия и марганца, могут вкрапляться в частицы глины или образовывать отдельные осадки. Ученые-почвоведы считают, что эти оксидные осадки являются частью глинистой фракции. В тропических и других старых, где есть сильно выветрившиеся почвы, оксиды железа и алюминия часто составляют большую часть глинистой их составляющей.
2. Органическое вещество
Органическое вещество имеет биологическое происхождение. Остатки водорослей, бактерий, растений, опавших листьев и останков рыб после разложения, представляют собой типичное органическое вещество донных отложений. Хотя органическое вещество может составлять лишь небольшую часть веса почвы, возможно, всего 2%, оно как правило покрывает 90% площади поверхности частичек почвы [3].
Органическое вещество в конечном итоге распадается на гуминовые вещества (например, «гумус»), обладающие множеством отрицательных зарядов, которые притягивают и связывают катионы питательных веществ, такие как Fe3+ и Cu2+. Источник отрицательного заряда гумуса (и способности связывать питательные вещества) находится в его различных гидроксильных, карбоксильных и фенольных группах (рис. VIII-1).
Рисунок VIII-1 отрицательно заряженные группы на поверхности перегноя

Гумус составляет 60 - 80% органического вещества почв суши [5] и около 25% всего органического вещества озерных отложений [6]. Он приносит пользу растениям, делая более доступными питательные вещества в почвенном растворе и защищая корни растений от токсичности металлов.
3. Осадочное неорганическое вещество
Источником осадочного неорганического вещества являются оболочки диатомовых водорослей из силикатов кремния. Также в аквариумах, в которые постоянно поступает корм для рыб, могут образовываться большие отложения нерастворимых фосфатов железа, фосфатов кальция и карбонатов кальция. Например, большинство рыбных кормов содержат перемолотую рыбу («рыбную муку»), которая содержит фосфат кальция из рыбных костей и зубов. Этот фосфат кальция в неповрежденном виде проходит через кишечник рыб и накапливается в субстрате аквариума как часть ила.
4. Микроорганизмы
Поверхность субстрата, в отличие от воды над ним, является домом для многих микроорганизмов. Например, в озерных донных отложениях содержится около миллиарда бактерий на грамм осадка [7]. А количество бактерий в песчаных фильтрах установившихся аквариумов, как морских, так и пресноводных, составляет около 10 миллионов на грамм песка [8].
В водных субстратах живут не только бактерии, но и простейшие, грибы, водоросли и дрожжи [9]. Микроорганизмы живут плотными колониями, прикрепленными к частицам субстрата. На рис. VIII-2 показана типичная колонизация песчинок, где небольшие колонии микроорганизмов (от 10 до 100 особей) часто образуются на участках между большими незаселенными территориями.
Рис. VIII-2. Схема расположения водных микроорганизмов на песчинке.
 Штриховкой обозначены участки, окрашенные при обработке песка различными гистологическими пятнами; окрашенные участки, скорее всего, представляют собой вкрапленное органического вещества. Линия внизу соответствует 100 мкм, что эквивалентно 0.1 мм.
Штриховкой обозначены участки, окрашенные при обработке песка различными гистологическими пятнами; окрашенные участки, скорее всего, представляют собой вкрапленное органического вещества. Линия внизу соответствует 100 мкм, что эквивалентно 0.1 мм.Характеристики почв и донных отложений
Связывание питательных веществ
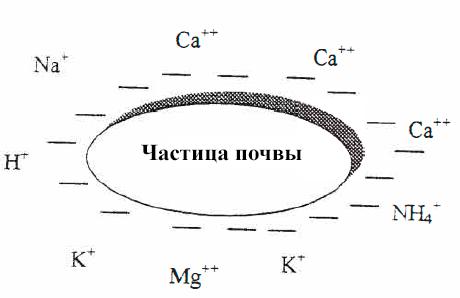
Частицы почвы, особенно глины, всегда заряжены отрицательно.
Это связано с тем, что ион силикона (Si4+) в исходной структуре почвы постепенно замещается другими катионами (например, Na- и K-) с меньшим количеством положительных зарядов.
Поскольку внутри частица почвы заряжена отрицательно, то на внешнюю ее поверхность притягиваются катионы, включая такие важные для растений питательные вещества, как Ca2+, NH4+, Mg2+ и K+ (рис. VII-3) (катионы - это атомы или небольшие молекулы, несущие положительный заряд).
Рис. VII-3. Связывание катионов с частицами почвы.

У глины площадь поверхности в 10 000 раз больше, чем у песка [12], поэтому глина гораздо сильнее связывает питательные вещества, чем песок. Таким образом, только благодаря глине и гумусу, а не песку или илу, почва может связывать катионы.
Связывание почвой катионов не дает питательным веществам попадать из субстрата в воду. На самом деле частицы почвы могут даже вытягивать такие питательные вещества, как медь, из вышележащей воды [13].
Частицы почвы также связывают отрицательно заряженные питательные вещества, «анионы», такие как фосфаты (HPO42- и H2PO42-). (Это связано с тем, что анионы притягиваются к катионам, связанным с частицами почвы.) Таким образом, фосфаты легко адсорбируются на оксидах железа или могут непосредственно вступать в реакцию с железом [14]. Действительно, если сосуд с концентрированным раствором фосфата и почвой в нем встряхнуть как следует, то почва удалит фосфат из раствора [15].
Поэтому донные отложения обычно содержат гораздо более высокие концентрации фосфатов, чем вышележащая вода [14]. В прудах рыборазводческих хозяйств часто наблюдается большой разрыв между концентрацией фосфора в воде и грунтовых отложениях. В одном пруду вышележащая вода содержала очень мало фосфора, всего 0.04 частей на миллион (рис. VIII-4). В грунте же наоборот, на каждый килограмм отложений приходилось 1000 мг связанного почвой фосфора. Можно сказать, что в почве концентрация фосфора в 25 000 раз выше, чем в воде.
И такая разница не только потому, что в почве изначально было больше фосфора, но и по причине активного притягивания фосфора частицами почвы. Поэтому, когда в пруд добавляли фосфор в качестве удобрения (чтобы стимулировать рост водорослей для кормления рыб и/или креветок), он удалялся из воды в течение нескольких недель, и его концентрация возвращалась к прежнему уровню. Правда некоторое количество фосфора было поглощено водорослями, но большая его часть была связана почвой [20].
Некоторые питательные вещества, особенно такие микроэлементы, как Fe2+, Zn2+ и Cu2+, связываются с РОУ (растворенным органическим углеродом) в почвенном растворе. Это связывание способствует усвоению питательных веществ корнями растений. (Питательные вещества, связанные с гуминовыми веществами и органическими кислотами, гораздо более доступны растениям, чем заблокированные в осадках оксидов металлов.)
Такие питательные вещества, как фосфаты, медь, молибдат и цинк, часто находятся в осадках оксидов металлов. Растения могут делать их доступными для себя путем обычного корневого дыхания. СО2 выделяется из дыхательных путей на кончиках корней, подкисляет почвенный раствор, который медленно растворяет оксиды. Корни растений также активно выделяют органические кислоты, такие как лимонная, щавелевая и кофейная [16, 17], которые помогают растворять питательные вещества, например, железо и фосфат. Когда оксиды металлов в осадках распадаются, соответствующие питательные микроэлементы и фосфаты попадают в почвенную воду [18]. И корни растений могут легко поглощать эти питательные вещества.
Рисунок VIll-4. Распределение фосфора (P) в пруду.

Анаэробная природа субстратов
Общая черта дискуссий о питательности или токсичности субстратов - насколько они «аэробны» или «анаэробны». Природные донные отложения (и субстраты для аквариумов) всегда лишены кислорода, поэтому термин «анаэробный», означающий отсутствие кислорода, по существу не имеет смысла. Чем анаэробные субстраты отличаются друг от друга, так это своей способностью принимать электроны.
Например, субстрат, богатый свежими органическими веществами и нейтральным pH, способствует активности бактерий и высвобождению электронов. Такие субстраты накапливают электроны, и поэтому теряют способность принимать новые. Песчаный субстрат, наоборот, накапливает меньше электронов и, следовательно, обладает большей способностью принимать новые электроны. Хотя оба субстрата могут быть одинаково лишены кислорода, у субстрата с органикой, вероятно, будет гораздо более низкий «окислительно-восстановительный потенциал», чем у песчаного субстрата.
Окислительно-восстановительный потенциал или редокс потенциал - это точная и численная характеристика способности раствора принимать электроны. Это просто разница напряжений в милливольтах между эталонным водородным электродом и платиновым электродом, помещенными в раствор.
Взаимосвязь между редоксом и акцепторами электронов в гипотетическом аквариуме с растениями можно описать следующим образом: поскольку аквариумная вода должна содержать кислород для дыхания рыб, следовательно в ней много оптимальных акцепторов электронов (то есть кислорода) и, следовательно, высокий окислительно-восстановительный потенциал (+800 мВ). Картина резко меняется по мере того, как мы погружаемся в субстрат. В слое гравия аэробные бактерии израсходовали большую часть кислорода, поэтому окислительно-восстановительный потенциал снизился с + 800 до +200 мВ. Несмотря на то, что этот слой обеднен кислородом, но он по-прежнему богат эффективными акцепторами электронов - нитратами. Их охотно используют многие бактерии. Однако по мере того, как мы спускаемся ниже слоя гравия, эффективных акцепторов электронов становится все меньше. В нижней части почвенного слоя окислительно-восстановительный потенциал может упасть почти до -200 мВ. Здесь специализированные бактерии используют сульфаты или само органическое вещество для приема электронов в различных процессах ферментации.
Окислительно-восстановительные потенциалы типичных химических реакций в воде и почве перечислены в Таблице VIlI-1 в порядке уменьшения эффективности.
Таблица VIlI-1. Редокс типичных химических реакций в воде и донных отложениях [21].
| Редокс (мВ) | Химическая реакция | Описание |
|---|---|---|
| +816 | 02 + 4H+ + 4e- = 2H2O | Насыщенная кислородом вода |
| +421 | NO3- + 2H+ + 2e- = NO2- + H2O | Денитрификация (первый шаг) |
| +396 | MnO2 + 4H+ + 2e- = Mn2+ + 2H2O | Растворение марганца |
| -182 | Fe(OH)3 + 3H- + e- = Fe2+ + 3H2O | Растворение железа |
| -215 | SO42- + 10H+ + 8e- = H2S + 4H2O | Выработка сероводорода |
| -244 | CO2 + 8H+ + 8e- = CH4 + 2H2O | Выработка метана |
| -413 | 2H- + 2e- = H2 | Выработка водорода |
Субстраты с высоким редоксом не идеальны. Например, когда исследователи [22] снизили окислительно-восстановительный потенциал донных отложений в нескольких норвежских озерах с +250 до +50 мВ, питательные вещества попали в воду грунта, и рост водных растений увеличился в 13 раз. Растительность, в которой преобладали мелкие изоэтиды сменилась плотными зарослями Juncus bulbosus (Ситник луковичный).
В субстратах со слишком низким редоксом (ниже -100 мВ) растениям тоже непросто живется. Чтобы получать энергию, корням приходится использовать ферментацию - очень не эффективный процесс. Также могут возникнуть проблемы с сероводородом и тяжелыми металлами. Один исследователь установил, что оптимальный для растений окислительно - восстановительный потенциал отложений расположен в диапазоне от +70 до +120 мВ [18].
Окисленная микрозона удерживает в грунте питательные вещества и токсины
Окисленная микрозона - это верхний слой грунта. Она отделяет среду донных отложений от аэробной вышележащей воды. Даже если ее толщина будет составлять всего несколько миллиметров, все равно она чрезвычайно важна.
Во-первых, она предотвращает диффузию питательных веществ в вышележащую воду [23]. Например, растворимое железо (Fe2+), диффундирующее вверх из глубин грунта, в окисленной микрозоне образует нерастворимые оксиды железа (FeOOH). Поскольку фосфаты легко образуют связи с оксидами железа, железо отлавливает их в окисленной микрозоне. Обнаружилось, что в одной прибрежной морской среде сезонное увеличение содержания FeOOH (окисленного железа) контролирует уровень P в воде [24].
Во-вторых, окисленная микрозона является местом безудержной активности бактерий, некоторые из которых приносят пользу водным экосистемам (включая аквариумы). Здесь различные бактерии нейтрализуют аммоний и сероводород, образующиеся в нижних отложениях, и предотвращают попадание этих токсинов в вышележащие воды. Окислители метана превращают метан в CO2, доступный растениям. Гетеротрофные бактерии превращают органику в такие питательные вещества, которые могут использовать растения. Если этот поверхностный слой будет анаэробный, а не окисленный, могут возникнуть проблемы.
Стабильность донных отложений и затопленной почвы
Донные отложения и почвы, находящиеся под водой долгое время, очень стабильны с точки зрения окислительно-восстановительного потенциала и pH [18]. Например, в одном исследовании, по изучению воздействия кислотного дождя, было установлено, что даже когда pH воды снижается до 5.0 на период 60 дней, донные отложения сохраняют свой щелочной pH [25].
Желательно, чтобы pH субстрата был нейтральным. Если pH слишком высок, то металлы окислятся и такие питательные вещества, как железо, станут менее доступными растениям. Если pH слишком низкий, происходит интенсивное растворение оксидов металлов, высвобождение алюминия, железа и т. д. в воду грунта, что приводит к отравлению растений металлами. Субстрат с pH = 6.6 считается для растений идеальным - соблюдается баланс между доступностью питательных веществ и токсичностью металлов.
Большая часть научной литературы по токсичности погруженных под воду почв основана на краткосрочных исследованиях заболоченных или затопленных наземных почв [26]. Действительно, первоначальное погружение земной почвы под воду вызывает большое количество химических и биологических реакций, которые могут быть вредными для растений и рыб. Однако, если почва продолжает оставаться под водой, эти реакции замедляются, и почва стабилизируется в течение нескольких месяцев. pH стремится к нейтральному, и в конце концов окислительно-восстановительный потенциал перестает снижаться. Эта стабильность наступает благодаря действиям как биологических, так и химических сил.
В погруженной под воду земной почве активность бактерий замедляется по мере того, как истощаются свежие органические вещества и эффективные акцепторы электронов. Более того, обратимая химическая реакция между Fe(OH)3 и Fe3(OH)8, как полагают, стабилизирует окислительно-восстановительный потенциал и pH кислых почв, тогда как буфер из карбоната кальция стабилизирует щелочные почвы [21].
Рисунок VlII-5. Стабилизация pH в шести различных земных почвах после погружения под воду

Как видно из рис. VIII-5, pH различных наземных почв стремится к относительно нейтральному значению в течение 2 – 4 недель после погружения. Таким образом, щелочные почвы становятся менее щелочными, а кислые - менее кислыми.
Хаос в свежезатопленных земных почвах
Химическая и биологическая нестабильность земных почв в течение первых двух месяцев после погружения хорошо задокументирована [18, 21]. Хотя эта временная нестабильность будет зависеть от содержания в наземной почве органики, pH и т.д., при ее затоплении постоянно происходят следующие события.
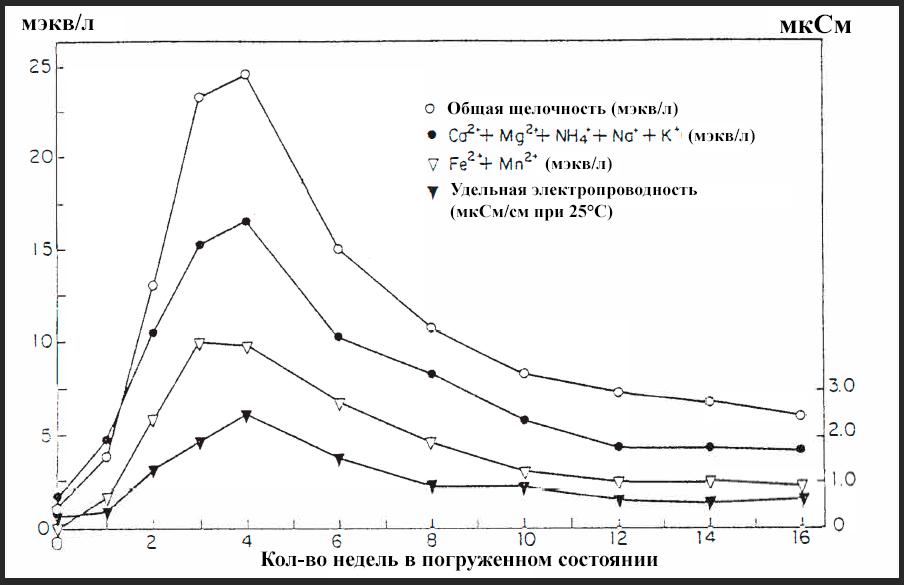
Во-первых, почти сразу прекращается доступ кислорода в затопленную почву. В течение нескольких дней оставшийся кислород быстро расходуется бактериями и химическими реакциями в почве. Вследствие этого растворимое железо (Fe2+) и марганец (Mn2-) заполняют воду почвы, вытесняя катионы (Na+, K+, Ca2+, Mg2+ и т. д.) из частиц почвы. Эти катионы накапливаются в почвенной воде, удельная проводимость значительно увеличивается. Наконец, при бактериальном разложении органики почвы в анаэробных условиях в почвенную воду попадают аммиак, сероводород и органические кислоты (уксусная, муравьиная, масляная и пропионовая кислоты).
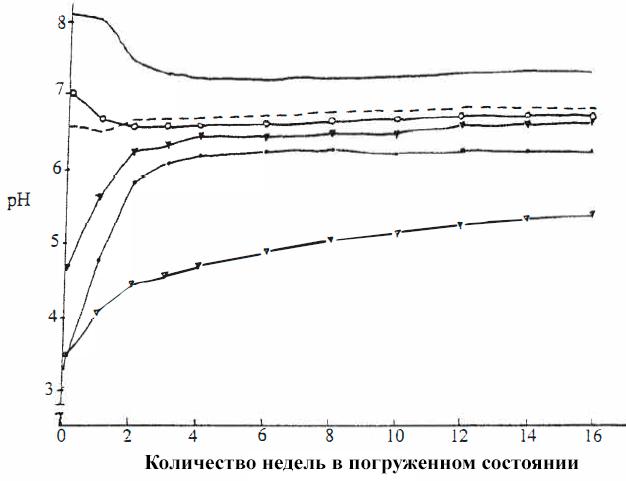
На рисунке VIII-6 показано протекание вышеупомянутых событий во времени на примере одной затопленной почвы. Различные химические вещества заполняют почвенный раствор в течение первых нескольких недель, но примерно через 8 недель эти химические вещества начинают исчезать из почвенного раствора по мере «оседания» почвы.
Рисунок VIII-6. Происходящие изменения воды в свежезатопленной почве.

Влияет ли этот химический хаос на рост растений? Чтобы проверить это, я провела небольшой эксперимент, с целью увидеть, повлияет ли продолжительность погружения почвы под воду на рост Vallisneria spiralis (Таблица VIII-2).
Таблица VIII-2. Влияние продолжительности погружения почвы под воду на рост Vallisneria spiralis
Я добавляла 1 стакан садовой земли, 1 стакан песка и 1,5 литра водопроводной воды в три двухлитровые банки каждые 2 недели. (Банки стояли в темноте при температуре около 80°F (27°С)). Через 6 недель я сменила воду и подсадила во все 12 банок маленькую V. spiralis. Растения росли еще 4 недели, потом собрала их и высушила.
| Кол-во недель в погруженном состоянии | Прирост (%) |
|---|---|
| 0 | 160 |
| 2 | 170 |
| 4 | 160 |
| 6 | 230 |
Я добавляла 1 стакан садовой земли, 1 стакан песка и 1,5 литра водопроводной воды в три двухлитровые банки каждые 2 недели. (Банки стояли в темноте при температуре около 80°F (27°С)). Через 6 недель я сменила воду и подсадила во все 12 банок маленькую V. spiralis. Растения росли еще 4 недели, потом собрала их и высушила.
Valisneria spiralis хорошо росла в свежезатопленной почве, но еще быстрее (примерно на 40%) росла в почве, которая была под водой 6 недель до посадки. Замачивание почвы менее 6 недель не принесло никаких преимуществ.
Наземные почвы и донные отложения для выращивания водных растений
Исследователи неоднократно доказывали, что водные растения намного лучше растут в донных отложениях или почве, чем в песке [31, 32]. Водные ботаники могут использовать мелкозернистые неорганические донные отложения, содержащие в основном ил [27], или наземные почвы, богатые органикой [28]. Например, 6 видов погруженных растений росли в 2-7 раз быстрее в смеси песка, садовой почвы и перегноя (в равных частях), чем в чистом песке [28]. А один исследователь [33] приготовил субстрат из 3 частей почвы и 1 части перегноя и успешно выращивал в нем «трудных» криптокорин.
Иногда почва, в которой водные растения хорошо растут, может отличаться от почвы естественной среды их обитания. Так, Isoetes lacustris (Послушник озерный) в естественной среде обитания растет в иле, содержащем 8% органических веществ. Однако в грунтах, содержащих 24% органических веществ растение растет лучше [31]. Возможно, что места обитания Isoetes lacustris ограничиваются бедной и иногда неблагоприятной средой потому, что это медленнорастущее растение не может конкурировать с быстрорастущими растениями в более благоприятных условиях.
Похоже, что в целом, водные растения, хорошо себя чувствуют в различных почвах - глинах или суглинках с некоторым количеством органики [34]. На самом деле, мне не удалось найти каких-либо серьезных или постоянных различий в росте растений на всяких обычных почвах. В том моем эксперименте, где я выращивала растения в отдельных банках, Vallisneria spiralis так же хорошо росла в щелочной пустынной почве (pH 8.0), как и в верхнем слое почвы из моего двора (красная глина с юго-востока, которую я посыпала известью).
В другом исследовании, в котором я выращивала альтернантеру в отдельных горшках, но в одном аквариуме, обнаружилось, что растения хорошо росли в горшечной почве и в глинистом верхнем слое почвы моего двора [35]. Однако растения плохо росли в подобных глинистых подпочвах, вероятная причина - отравление марганцем. В большинстве случаев удобрение субстрата оказывалось либо вредным, либо бесполезным. Лучший рост растений (в условиях аквариума) часто оказывается не в самой плодородной почве, а в той, которая наименее токсична.
Проблемы с донными отложениями и затопленными почвами
Анаэробные водонасыщенные отложения добавляют некоторые проблемы водным растениям, в виде токсичности тяжелых металлов, сероводорода, низкого окислительно-восстановительного потенциала и органических кислот.
1. Токсичность металлов
Я лично столкнулась с отравлением растений железом, когда смешала почву для цветов с латеритом, который продается как богатая железом глина. (Я тогда ошибочно думала, что мне нужно добавить в субстрат железо). Хотя я насыпала всего только около стакана латерита в нижний слой цветочной почвы, но в течение двух недель корни всех плавающих растений отмерли. Яванский папоротник покоричневел и погиб. Растения, укоренившиеся в субстрате, погибли не сразу, но со временем они оторвались от грунта и всплыли на поверхность. Тесты показали высокий уровень железа в воде. (Обычно в моих аквариумах тесты не определяют наличие железа в воде). Кроме того, в этом аквариуме у меня была постоянная проблема с водорослями. В конце концов, я сдалась и разобрала аквариум. Полагаю, что сильная кислотность и высокое содержание гумуса в цветочной почве растворили огромное количество железа из латерита, что привело к отравлению растений.
Токсичность металлов обычна в кислых почвах, особенно в подпочвах, содержащих мало защитного гумуса. Кислотность и первое затопление почвы водой вызывают высвобождение большого количества металлов, таких как алюминий, марганец и железо из осажденных оксидов в почвенный раствор. Исследователи установили, что токсичность железа может проявиться, когда его уровень в почвенной воде достигнет 1 мМ (~ 56 ppm) [21].
Отравляющее действие металлов может быть уменьшено диффузией кислорода из корней растений. Как ни странно, очень токсичный сероводород может снизить токсичность металлов путем их осаждения из почвенного раствора. Например, водоросли Halodule wrightii, по-видимому, лучше растут в тех донных отложениях, в которых достаточно H2S для снижения уровня растворимого железа [21]. (Растворимое железо вступает в реакцию с H2S с выпадением в осадок FeS2 (железный пирит)).
Токсичность сероводорода (H2S)
Даже в очень малых концентрациях (0,034 ppm) сероводород подавляет рост и функционирование корней [21]. Симптомами отравления сероводородом являются почерневшие и чахлые корни. В аквариумах отравление растений сероводородом может привести к плохому их росту, отрыву от грунта и всплытию на поверхность.
Механизм отравляющего действия H2S плохо изучен, но, поскольку сера довольно токсична для многих организмов, включая млекопитающих [37], она, вероятно, влияет на базовую функцию клетки, такую как активность фермента. (Многие важные ферменты содержат металлы железо и цинк, которые могут вступать в реакцию с H2S, тем самым деактивируя фермент.) Исследование действия сероводорода на болотные растения установили, что сульфид деактивирует фермент алкогольдегидрогеназу, тем самым подавляя ферментацию и рост растений [38].
Все донные отложения, кажется, содержат некоторое количество сульфидов [31], а в отложениях с большим количеством органики и сульфатов они создаются еще. Я столкнулась с отравлением растений сероводородом после добавления сульфатсодержащего удобрения в почвенный субстрат [35]. Растения стали плохо расти. Их корни почернели и зачахли. То же удобрение, добавленное в садовую почву, никого не отравило.
Несмотря на токсичность сероводорода, водные растения в природе, по-видимому, научились справляться с некоторым его количеством. Также защиту растениям дает кислород, который они выделяют через корни. С его помощью бактерии окисляют H2S. Растворимое железо (Fe2+) в почвенной воде тоже защищает корни [21].
Рыбам сероводород, вероятно не причинит вреда, так как в присутствии кислорода он почти мгновенно окисляется до безвредных сульфатов. Диффундирующий со дна сероводород быстро превращается в сульфаты бактериями. Также было установлено, что в насыщенных кислородом болотных водах содержание сероводорода незначительно, даже несмотря на большую его концентрацию в донных отложениях [39].
Органическое вещество
Считается, что органика в донных отложениях - это беда для водных растений. Однако мнения ботаников на этот счет неоднозначны. Например, когда исследователи [27] добавляли листья, водоросли или хвою (5% добавок) в плодородные осадочные отложения озера, гидрилла росла медленнее. Однако у других исследователей [32] гидрилла росла быстрее в земной почве с добавлением ячменной соломы или речного торфа (добавка 5-20%).
Выяснилось, что виды водных растений, которые в экспериментах с добавлением органики в почву стали хуже расти, в основном происходят из областей с умеренным климатом и озер с жесткой водой. Например, Барко (Barko) и Смарт (Smart) [27] в своем классическом исследовании, показывающем замедление роста растений органическими веществами в донных отложениях, использовали Hydrilla verticillata, Myriophylium spicatum и Elodea canadensis, все жестководные виды.
Полупогруженные растения и растения, растущие в мягких водах лесных озер, полных опавших листьев, возможно меньше ингибируются (а фактически даже наоборот) органическими веществами донных отложений.
Этиловый спирт и органические кислоты - продукты разложения бактериями органических веществ субстрата в анаэробных условиях. Хотя этанол тоже не есть хорошо для водных растений, он редко встречается в грунте в опасных концентрациях [40]. Скорее органические уксусная, масляная, пропионовая и муравьиная кислоты могут представлять опасность для водных растений [21], особенно в свежезатопленных почвах, где их концентрации могут достигать 15 - 45 мМ [18]. Как показало исследование, в такой концентрации обычная уксусная кислота подавляет размножение гидриллы [41].
Низкий окислительно-восстановительный потенциал (редокс)
Для осуществления нормального (аэробного) обмена веществ и выработки энергии корням растения требуется кислород. Если у субстрата очень низкий редокс и корням не хватает кислорода, для получения энергии они вынуждены прибегать к ферментации. Хотя водные растения, особенно полупогруженные, могут какое-то время выживать ферментируя накопленные углеводы, этот процесс их постепенно истощает. Таким образом, ферментация у растений связана с низким поглощением азота и медленным ростом.
Кислые сульфатные почвы
В прибрежных почвах часто содержится много пирита железа (FeS2). Их называют «кислыми сульфатными почвами», потому что они кислеют при увлажнении и высыхании. Например, у почвы из приливных болот Южной Каролины, содержащей более 5% серы, при повторном погружении под воду pH был равен двум или трем [43]. Когда эта почва была затопленной и анаэробной, проблем с кислотностью не было. Однако на воздухе, под воздействием кислорода образовалась серная кислота (H2S04):
FeS2 + H2O + 31/2O2 => FeSO4 + H2SO4
Кислые сульфатные почвы могут стать причиной серьезных проблем в рыборазводческих прудах. Когда пруды осушаются для того, чтобы собрать рыбу, в обнажившейся на воздухе почве образуется серная кислота. Когда пруды снова наполняются водой, кислота попадает в нее и может снизить pH до 2 или 3.
Мутность
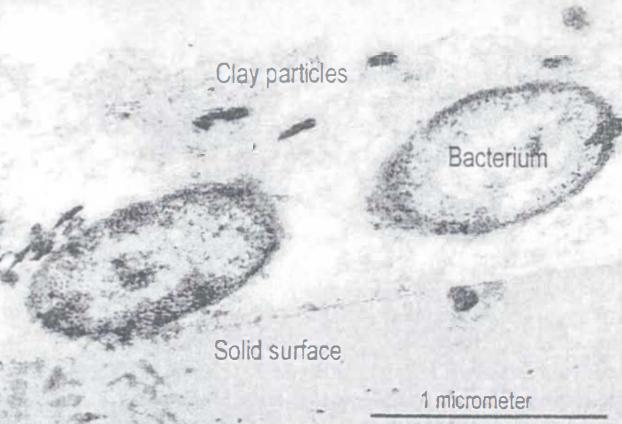
Муть в воде - это не только мелкие частички почвы. Даже грунты, содержащие мельчайшие частицы глины, могут не замутить воду. Виноваты бактерии и многовалентные катионы (например, Ca2+ и Fe3+), агрегирующие мельчайшие частицы почвы.
Бактерии в природе любят прикрепляться к поверхностям и жить в среде, называемой биопленкой. Они производят полисахаридные «липучки», которые собирают на себя частицы почвы, даже мельчайшие гуминовые вещества и частицы глины [44]. Сами же бактериальные биопленки, вероятно, не дают мелким частицам грунта попасть в воду и замутить ее.
На рисунке VIII-7 видны две бактерии, колонизировавшие пластиковый диск, подвешенный в альпийском ручье.
Рис. VIII-7. Частицы глины, захваченные бактериальной биопленкой.

Стать мутной вода может из-за избыточной электроотрицательности частиц почвы. Так бывает, когда слишком много одновалентных катионов связывается с частицами почвы. Например, натрий (Na+) с его единственным положительным зарядом не очень эффективно нейтрализует отрицательный заряд у частиц почвы. К примеру, солончаковая почва, в которой много связанного натрия, при погружении в воду может сильно замутить ее. (Если частицы глины заряжаются отрицательно сильнее чем обычно, они отталкиваются друг от друга и остаются во взвешенном состоянии.)
Почвы меньше замутняют воду, если отрицательно заряженные частички глины нейтрализуются ионами с множеством положительных зарядов (например, Al3+, Ca2 + и Mg2+). Поскольку частицы почвы менее отрицательны, они имеют тенденцию к агрегированию и выпадению в осадок. Поэтому рыбохозяйствам в регионах с солоноватыми почвами можно посоветовать добавлять известь или Al2(SO4)3 как средство против замутнения воды.
Влияние водных растений на субстраты
В результате своей жизнедеятельности корни растений выделяют много кислорода и органических соединений. Это стимулирует активность бактерий в ризосфере - области грунта, непосредственно (1 - 2 мм) окружающей корни. Было обнаружено, что бактерии, участвующие в аммонификации, образовании кислоты и восстановлении нитратов, концентрировались больше в ризосфере водного растения Myriophyllum heterophyllum (Перистолистник красностебельный), чем в окружающей его области без растений.
Еще одни исследователи обнаружили, что под участками, засаженными укореняющимися растениями Isoetes braunii и Myriophyllum tenellum, окислительно-восстановительный потенциал более высокий, чем под пустыми или покрытыми водным мхом [48]. Было подсчитано, что Potamogeton perfoliatus выделяет корнями количество кислорода, равное 3.8 мг/час. Такое выделение кислорода значительно усиливает денитрификацию глубоких слоев грунта [50].
Другой исследователь [51] установил, что корни Pontederia cordata (но не Sparganium eurycarpum) сильно стимулировали бактерий, участвующих в окислении метана.
Все эти данные свидетельствуют о том, что корни растений оказывают большое влияние на экологию донных отложений, способствуя переработке питательных веществ и токсинов. Без выделения кислорода и органических соединений корнями водных растений субстрат может превратиться в заиленную «мертвую зону».
Примером таких проблем у грунтов без растений служат пруды рыборазводческих хозяйств. В этих прудах, предназначенных для выращивания рыб и креветок, есть почва и взвешенные в воде водоросли, но нет укореняющихся растений. Почва в них со временем портится и скапливается много ила, который нужно удалять. Поверхность отложений через несколько лет становится все более анаэробной и теряет свою жизненно необходимую окисляющую зону. Ученые, изучающие аквакультуру, отметили замедление роста рыб в прудах, где поверхность почвы стала анаэробной, даже если вышележащая вода была нормально насыщена кислородом [53]. Рыба просто не так охотно будет есть пищу с этих старых анаэробных грунтов, как с более новых и аэробных. Возможно ли, что вода очищается и насыщается кислородом водорослями, а субстрат - нет? Без укореняющихся водных растений ухудшение субстрата весьма вероятно.
 Pontederia cordata. P. cordata обитает на мелководьях востока США. Исследователи установили, что ее корни очень помогали окислять метан. (Водные растения влияют на субстрат, выделяя корнями кислород и органические соединения.)
Pontederia cordata. P. cordata обитает на мелководьях востока США. Исследователи установили, что ее корни очень помогали окислять метан. (Водные растения влияют на субстрат, выделяя корнями кислород и органические соединения.)Субстраты в аквариумах
По моему опыту, аквариумы с грунтом из чистого гравия безнадежны для выращивания аквариумных растений. Из-за того, что растения плохо растут, требуется сифонить гравий, потом одолевают водоросли.
Я использую почвенную подложку в субстратах всех своих аквариумов, потому что результат меня устраивает и отвечает моим идеалам аквариумов, приближенных к естественной природной среде. Особенно полезна почва для растений в начале, когда аквариум только запущен и в нем мало питательных веществ. Почва обеспечивает укореняющиеся растения богатым источником питательных веществ с первого дня, что позволяет им взять хороший старт в борьбе с водорослями. Кроме того, при разложении почвенного органического вещества выделяется CO2, который растениям может сильно понадобиться в новом аквариуме. Богатая органикой почва для цветов даст много CO2.
Выбор почвы
В своих аквариумах я использую либо обычную почву для цветов, либо садовую почву. (Их не следует смешивать.) Обе одинаково хорошо подходят растениям. По прошествии некоторого количества лет могу сказать, что в аквариумах с почвой для цветов, похоже, было меньше проблем с водорослями, чем в аквариумах с садовой почвой. Думаю, что это из-за того, что богатая железом глина садовой почвы выделяет в воду железо, чего не происходит с почвой для цветов. (Железо в воде может стимулировать рост водорослей).
С другой стороны, почва для цветов может не подойти растениям в аквариумах с мягкой водой. (Во всех моих аквариумах вода жесткая). Это связано с тем, что и в мягкой воде, и в почве для цветов будет недостаток питательных веществ жесткой воды. Аквариумисту, возможно, придется периодически добавлять в аквариум Ca, Mg и K. Поэтому для аквариумов с мягкой водой садовая почва будет более подходящей, чем земля для цветов.
В. Запустил новый аквариум на 20 галлонов (75 л) с почвой для цветов в качестве подложки. В первую неделю растения чувствовали себя не очень хорошо, а плавающие и вовсе погибли. pH был меньше 5, а жесткость всего 3, поэтому я добавил немного соды, чтобы поднять pH. Что-нибудь еще я могу сделать?
О. Вы молодец, что так внимательно контролируете свой новый аквариум. Такая кислая вода определенно убьет растения [54]. А ваша мягкая водопроводная вода судя по всему не достаточно щелочная, чтобы нейтрализовать ту кислоту, которую почва для цветов могла выделить в воду. (Почва для цветов всегда кислая.)
Кроме повышения щелочности, я бы также повысила жесткость воды. Как в почве для цветов, так и в мягкой воде всегда не хватает каких-нибудь необходимых макроэлементов. Если вы не будете добавлять эти отсутствующие элементы, то в вашем аквариуме будут расти лишь мягководные растения и то медленно.
Отзыв. Добавил калия, кальция и магния. GH сейчас 8, pH стабилизировался. Растения и рыбы чувствуют себя прекрасно.
В. Почвы так сильно зависят от географии... Не могли бы вы дать мне рекомендации по использованию их в аквариуме?
О. Я бы взяла почву для цветов, либо верхний почвенный слой, который показался бы приемлемым для огородных грядок. Регион не важен. Не брала бы только подпочву или глинистую почву из прибрежных районов с солоноватой водой.
Обычные почвы для цветов хорошо показали себя и у меня и у других аквариумистов в аквариумах с жесткой водой.
Почва для цветов не всегда хорошо работает в глубоком горшке, куда мало попадает насыщенной кислородом воды. (В ней много органики, и она будет сильно анаэробной в глубине.) Поэтому любителей держать пруд, совершенно справедливо предостерегают от использования в нем растений, посаженных в большие, 1 - 3 галл, (4 - 10 л) контейнеры. А вот в качестве не толстой, 1 - 1.5 дюйма (2.5 - 4 см) подложки под аквариумным субстратом, она подойдет.
Не советую покупать почву для цветов, производитель которой в качестве разрыхлителя использует пенопластовые шарики - они всплывают на поверхность всякий раз, когда субстрат ворошится.
В кислые глинистые почвы юго-востока США я бы добавила доломитовую известь, чтобы стимулировать активность бактерий и уменьшить мутность. Когда я запускала аквариумы с кислой садовой почвой (pH 5.5), то перед помещением в аквариум, добавляла стакан доломитовой извести на галлон (3.8 л) почвы.
Запуск аквариумов с почвой
Я запускаю аквариумы с почвой несколькими способами. Самый легкий путь, вероятно, такой: покрываю дно аквариума слоем сухой почвы толщиной 1 - 1.5 дюйма (2.5 - 4 см). Засыпаю ее примерно дюймом (2.5 см) гравия, чтобы толщина субстрата составила около 2.5 дюйма (6 см). (Я не промываю гравий перед этим)
Заливаю в аквариум воду, чтобы она закрыла субстрат где-то на 3 дюйма (7,62 см). На следующий день сажаю растения, досыпаю гравий, сливаю мутную воду и заливаю новую до полного.
Обычно оставляю аквариум на ночь с включенным светом, фильтром и обогревателем. На следующий день добавляю кондиционер и запускаю рыб. Муть оседает примерно через день или два.
В. Хочу положить почву в аквариум, но не хочу все в нем разрушить. Есть ли способ засыпать почву, не создавая беспорядка?
О. Да, есть. Я оборачиваю порции земли вощеной бумагой, заклеиваю скотчем и подкладываю эти пакеты под гравий. Бумага постепенно разлагается и почва распределяется по всему дну под гравием. (Процесс пойдет быстрее если пакеты под гравием проковырять ножом)
Удобрение
Хорошо разложившееся органическое вещество (например компост) является неплохой добавкой к почве, потому что, в отличие от торфяного мха, у него относительно нейтральный pH. Компост можно смешать с почвой перед запуском аквариума. Я бы не стала добавлять в субстрат свежие органические вещества, например, навоз. Я бы, не смешивала торф с почвой из-за его сильной кислотности. (Кислотность может привести к токсичному уровню тяжелых металлов в грунтовой воде). Также не стала бы добавлять в почву неорганические удобрения. В затопленной почве неорганические удобрения легко могут стать токсичными. Многие удобрения для комнатных растений содержат большое кол-во сульфатов [(NH4)2SO4 и/или K2SO4. Они отлично подходят для наземных и полупогруженных растении, но для погруженных растений, растущих в анаэробных субстратах не годятся. (Бактерии превращают сульфаты в токсичный H2S, который может погубить корни.)
Добавление в почву нитратосодержащих удобрений тоже не вариант, так как бактерии легко превращают нитраты в ядовитые для рыб нитриты. Поскольку нитриты плохо связываются с частицами почвы, они быстро попадают в воду, где могут повредить рыбе. Как-то я собирала один свой аквариум (в то время жизнь меня еще не научила уважать нитратное дыхание бактерий) я добавила азотные удобрения в сухую почву. В течение недели я получила очень токсичные концентрации нитритов (1 - 2 ppm NO2-N) в воде.
Суть в том, что не стоит слишком переживать по поводу плодородия аквариумной почвы. На самом деле погруженные водные растения в аквариумах без дополнительной продувки CO2 растут слишком медленно, чтобы расходовать столько же питательных веществ, сколько потребляют растения на клумбе или грядке. Более того, питательные вещества, которые растения извлекут из почвы, будут постепенно заменяться питательными веществами из корма для рыб. Рыбий корм и есть удобрение для аквариума.
Добавки в гравий
Многие любители высокотехнологичных аквариумов эффективно выращивают растения, используя покупные добавки для гравия. (Немного этих веществ смешивается с нижним слоем гравия при запуске аквариума.)
Есть одно различие между моим методом и коммерческими добавками - я использую гораздо больший объем почвы, примерно в 50 раз больше. Например в аквариум объемом 45 галл (170 л) я засыпала около 3 галл (11 л) садовой земли. Если бы я запускала тот же аквариум с латеритом (продаваемым как добавка к гравию), я бы засыпала только около стакана латеритной почвы; остальное было бы гравием.
Благодаря большему объему почвы, почвенный метод обеспечивает гораздо больший запас питательных веществ, чем гравий с добавками. Кроме того, при разложении органики почвы в воду выделяется углекислый газ, что приносит большую пользу растениям в аквариумах без дополнительного CO2.
Такие добавки в гравий, как латерит, создавались для аквариумов с подачей CO2, донным течением и удобрением макро и микроэлементами. В этих условиях латерит способствует отличному росту растений. Короче, в высокотехнологичных аквариумах используется латерит, в низкотехнологичных (таких как у меня) используется почва.
Мысль о том, что коммерческая добавка для гравия более надежна и менее рискованна, чем горшечная или садовая почва, является привлекательной. Однако, несколько любителей, использующих различные добавки к гравию, сообщали о таких проблемах, как неконтролируемое помутнение воды, ухудшение субстрата и гибель донных рыб. Так что, на мой взгляд, нет никакой гарантии, что добавка для гравия, просто потому, что она поставляется в дорогой упаковке, а не в садовой лопате, менее опасна, чем обычный грунт.
Деградация субстрата со временем
Без укореняющихся растений и без донных фильтров субстраты со временем деградируют. По мере накопления органики и становясь все более анаэробными, они выделяют токсины, убивающие рыбу. Тем не менее, аквариумы с почвой и укореняющимися растениями, кажется, могут жить бесконечно долго без какого-либо обслуживания (например, без сифонивания).
В. Сегодня утром, когда я попытался покормить рыбок, я заметил, что у них, кажется, пропал аппетит. Может, в этом нет ничего страшного, потому что аквариум выглядит нормально; вода кристально чистая, да и в остальном рыба кажется здоровой.
Некоторые растения я растут у меня в горшках с почвой, а другие, например, роголистник и элодея, просто плавают. С ними все хорошо. Еще я пытаюсь растить растения в гравии (без почвы). Как ни странно, одно растение - эхинодорус амазонский, никак не пускает корни. Я пробовал прижать его камнями, но он все время всплывает. Может, гравий просифонить?
О. Я немедленно просифонила бы гравий. В долгосрочной перспективе использовала бы либо донный фильтр и пластиковые растения, либо почву с живыми. Чистый гравий без фильтра под ним быстро становится токсичным. Несмотря на то, что гравий выглядит чистым, органические вещества все равно накапливаются и разлагаются в анаэробных условиях. Выделяются анаэробные ядовитые H2S и органические кислоты. Растения не пускают корни, а рыбы теряют аппетит. Ирония в том, что хорошо растущие укореняющиеся растения могут предотвратить неизбежную деградацию субстрата, но растения плохо растут в чистом гравии, и не могут «выполнять свою работу» (то есть предотвращать накопление ядов).
В. Если у вас есть аквариум емкостью 75 галлонов (280 л) и вы положили 1 дюйм (2.5 см) почвы и засыпали его гравием, нужно ли удалять ее и заменять новой через год? Через два?
О. Срок службы почвы может зависеть от того, используете ли вы дополнительный CO2 или нет. Например, в «высокотехнологичных» аквариумах с подачей CO2 и внесением удобрений, но без рекомендуемого "теплого пола", часто растения в первый год демонстрируют впечатляющий рост. Затем субстрат начинает сдавать. (Рост растений замедляется, а водоросли разрастаются.) Это происходит несмотря на то, что растения хорошо удобряются всеми питательными веществами. Полагаю, что аллелохимические соединения и другие ингибиторы накапливаются в субстрате быстрее, чем разлагаются. Подогрев субстрата, по сути, постоянно «промывает» его, и может предотвратить его отравление.
В моих аквариумах (без подачи CO2), аллелохимические вещества накапливаются медленно, поэтому бактерии успевают их разложить, до того, как они станут серьезной проблемой. Истощение почвы не вызывает деградацию грунта. Если вы позволите накапливаться илу, пополняя тем самым запасы питательных веществ, потребляемых растениями, то почва сможет поддерживать хороший рост растений в течение многих лет. У меня есть аквариумы с подложкой из земли для цветов, которая была заложена 6 или 8 лет назад, и растения продолжают хорошо расти. У других аквариумов, с подложкой из садовой почвы, также все хорошо уже лет пять. (Однако растения в горшках с той же самой почвой, которую я использовала в аквариумах, стали сдавать уже через пару лет.)
Литература
1. Nortcliff S. 1988. Soil fonnation and characteristics of soil profiles. In: Wild A (ed.). Russell's Soil
Conditions and Plant Growth (11th Edition). John Wiley (NY), pp. 168-212.
2. Mott CJB. 1988. The inorganic components of the soil. In:. Wild A (ed.). Russell's Soil Conditions
and Plant Growth (11th Edition). John Wiley (NY), pp. 213-238.
3. Thurman EM. 1985. Organic Geochemistry ofNatural Waters. Martinus Nijhoff/DrW. Junk (Boston),
p. 367.
4. Boyd, CE. 1995. Bottom Soils, Sediment, and Pond Aquaculture. Chapman & Hall (NY), p. 40.
5. Boyd 1995, p. 22.
6. Barko JW and Smart R. М. 1986. Sediment-related mechanisms of growth limitation in submersed
macrophytes. Ecology 67: 1328-1.340.
7. Wetzel RG. 1983. Limnology (Second Ed.). SaW1ders College Publishing (Philadelphia, PA), p. 595.
8. Spotte S. 1979. Fish and Invertebrate Culture. Second Ed. Wiley-lnterscience Publications (NY), p.
8.
9. Rheinheimer G. 1985. Aquatic Microbiology (3rd ed.). John Wiley (NY).
10. Meadows PS and Anderson JG. 1966. Micro-organisms attached to marine and freshwater sand
grains. Nature 212: 1059-1060.
11. Marshall KC. 1976. Interfaces in Microbial Ecology. Harvard University Press, Cambridge, MA, p. 87.
12. Glass ADM. 1989. Plant Nutrition: An Introduction to Current Concepts. Jones & Bartlett Publishers
(Boston MA), p. 26.
13. Boyd 1995, p. 143.
14. Wetzel 1983, Ch. 13, 14.
15. Bayd.1995, p. 92.
16. Tyler G and Strom L. 1995. Differing organic acid exudation pattern explains calcifuge and acidifuge
behaviour of plants. Ann. Bot. 75: 75-78.
17. Hopkins WG. 1995. Introduction to Plant Physiology. John Wiley (NY), p. 76.
18. Ponnamperuma FN. 1981. Some aspects of the physical chemistry of paddy soils. In: Proceedings of
Symposium on Paddy Soil. Institute of Soil Science, Academia Sinica (ed.), Springer-Verlag (NY),
pp. 59-94.
19. Boyd 1995, p. 94.
20. Boyd 1995, p. 132.
21. Rowell DL. 1988. Flooded and poorly drained soils. In: Wild A (ed.). Russell's Soil Conditions and
Plant Growth (11th Edition). John Wiley (NY), pp. 899-926.
22. Roelofs JGM, Brandrud TE, and Smolders AJP. 1994. Massive expansion of Juncus bulbosus L.
after liming of acidified SW Norwegian lakes. Aquat. Bot. 48: 187-202.
23. Wetzel 1983, p. 261.
24. Jensen HS, Mortensen PB, Andersen FO, Rasmussen E, and Jensen A. 1995. Phosphorus cycling in a
coastal marine sediment, Aarhus Bay, Denmark. Limnol. Oceanogr. 40: 908-917.
25. Grise D, Titus JE, and Wagner DJ. 1986. Environmental pH influences gro-wth and tissue chemistry
of the submersed macrophyte Vailisneria amertcana. Can. J. Bot. 64: 306-310.
26. Drew MC and Lynch JM. 1980. Soil anaerobiosis, rnicroorganisms, and root function. Annu. Rev.
Phytopathol. 18: 37-66.
27. Barko JW and Smart RNl. 1983. Effects of organic matter additions to sediment on the growth of
aquatic plants. J. Ecol. 71: 161-175.
28. Denny P. 1972. Sites of nutrient absorption in aquatic macrophytes. J. Ecol. 60: 819-829.
29. Bowen HJM. 1979. Environmental Chemistry of the Elements. Academic Press (NY), pp. 36-37, 42-
43.
30. Donahue RL, Miller RW, and Shickluna JC. 1983. Soils. An Introduction to Soils and Plant Growth
(Fifth Ed.). Prentice-Hall (Englewood Cliffs, NJ), p. 140.
31. Misra RD. 1938. Edaphic factors in the distribution of aquatic plants in the English lakes. J. Ecol.
26: 411-451.
32. Spencer DF, Ksander GG, and Bissell SR 1992. Growth of monoecious Hydrilla on different soils
amended with peat or barley straw. J. Aquat. Plant Manage. 30: 9-15.
33. Jacobsen N. 1992. Cultivation of some difficult Cryptocoryne species in humus-rich beech leafmould.
The Aquatic Gardener 5(5): 133-137.
34. Gopal Band Sharma KP. 1990. Ecology of Plant Populations I: Growth. In: Gopal B (ed.), Ecology
and Management of Aquatic Vegetation in the Indian Subcontinent, Kluwer Academic Publishers
(Boston MA), pp 79-106.
35. Walstad DL. 1994. Soil Substrate Experiment. The Aquatic Gardener 7(5): 171-183.
36. Pulich WM Jr. 1982. Edaphic factors related to shoalgrass (Halodule wrightii Aschers.) production.
Bot. Mar. 25: 467-475.
37. Bowen 1979, p. 149.
38. Koch MS, Mendelssohn IA, and McKee KL. 1990. Mechanism for the hydrogen sul.fide-induced
growth limitation in wetland macrophytes. Lirnnol. Oceanogr. 35: 399-408.
39. Westermann P. 1993. Wetland and swamp microbiology. In: Ford TE (ed.). Aquatic Microbiology.
An Ecological Approach, pp 205-238.
40. Smits AJM, Laan P, Thier RH, and van der Velde G. 1990. Root aerenchyma, oxygen leakage patterns
and alcoholic fermentation ability of the roots of some nymphaeid and isoetid macrophytes in
relation to the sediment type of their habitat. Aquat. Bot. 3 8: 3-17.
41. Spencer DF and Ksander GG. 1995. Differential effects of the microbial metabolite, acetic acid, on
sprouting of aquatic plant propagules. Aquat. Bot. 52: 107-119.
42. Yamasaki S, Kimura M, and Yoneyama T. 1992. Early withering of lower leaves of Phragmites
australis (Cav.) Trin. ex Steud. in a eutrophic stand: Role of oxygen concentration, fate of nitrogen
and nitrogen uptake by the plants. Aquat. Bot. 42: 143-157.
43. Boyd 1995, p. 49.
44. Payne D. 1988. Soil structure, tilth and mechanical behav:ior. In: Wild A (ed.). Russell's Soil Conditions
and Plant Growth (11th Edition). John Wiley (NY), pp. 378-411.
45. Costerton -rw. 1980. Some techniques involved in study of adsorption ofmicroorganisms to surfaces.
In: Bitton G and Marshall KC, Adsorption of Microorganisms to Surfaces, John Wiley (NY), pp 403-
425.
46. Boyd 1995, p. 39, 237.
47. Blatnick JR. Rho J and Gunner HB. 1980. Ecological characteristics of the rhisosphere microflora of
Myriophyllum heterophyllum. J. Environ. Qual. 9: 207-210.
48. Jaynes ML and Carpenter SR. 1986. Effects of vascular and nonvascular macrophytes on sediment
redox and solute dynamics. Ecology 67: 875-882.
49. Caffrey JM and Kemp WM. 1991. Seasonal and spatial patterns of oxygen production, respiration
and root-rhizome release in Potamogeton perfoliatus L. and Zostera marina L. Aquat. Bot. 40: 109-
128.
50. Caffrey JM and Kemp WM. 1992. Influence of the submersed plant, Potamogeton perfoliatus, on
nitrogen cycling in estuarine sediments. Limnol. Oceanogr. 37: 1483-1495.
51. Calhoun A and King GM. 1997. Regulation of root-associated methanotrophy by oxygen availability
in the rhizosphere of two aquatic macrophytes. Appl. Environ. Microbial. 63: 3051-3058.
52. Muenscher WC. 1944. Aquatic Plants of the United States. Comstock .Publishing Inc., Cornell University
(Ithaca NY).
53. Boyd 1995, p. 263.
54. Arts GHP, Roelofs JGM, and De Lyon MJH. 1990. Differential tolerances among soft-water macrophyte
species to acidification. Can. J. Bot. 68: 2127-2134.




***
Комментарии: